上海市浦东新区蔡伦路780号8层810室
新闻动态
喜讯!《Science Advances》刊登:3D培养技术新突破,朴衡NAC-Organ技术引领药物筛选新时代
未来药物筛选新突破:基于DNA折纸结构的可设计3D细胞球体模型
传统的细胞培养和动物模型在预测人体药物反应、探索致病机制上有其固有局限性,新兴的体外3D培养技术有望在多个方面突破传统方法的限制。随着外模型的仿真性、生理相关性的不断突破,培养系统也变得越来越复杂,这阻碍了其在自动化、高通量药物筛选流程上的整合。传统的细胞球体模型虽适合高通量筛选,但无法复现组织器官的复杂结构,从而限制了对复杂疾病的精确建模。因此,开发能在模型复杂性和可操作性之间取得平衡的新型仿生组织工程策略成为推动技术实用化的关键挑战。

DOI:10.1126/sciadv.ado9880
2024年7月19日,朴衡博迈(上海)生物医药有限公司宋光启博士团队、华东师范大学朱通教授、裴昊教授团队、复旦大学附属中山医院沈锡中教授、姚群燕教授团队、吉林大学赵翊丞教授团队在国际期刊《Science Advances》上,在线发表了题为《Designer Cellular Spheroids with DNA Origami for Drug Screening》的最新研究成果。这项研究介绍了一种的DNA折纸纳米结构分子胶水 NAC-Linkers 构建的类肝微组织的方法,可在保留3D细胞球体模型关键优势的同时,模拟复杂疾病的组织微环境,为大规模制备标准化的复杂疾病3D模型提供了可能。基于该方法搭建了经济高效的药物筛选平台,以靶点和表型为导向的药物筛选策略,包括靶点鉴定、分子候选物的人工智能筛选、药物处理、高内涵成像分析及数据解读,实现潜在药物的筛选及验证。
基于框架核酸的3D培养技术实现细胞球体的标准化规模化生产
在药物筛选领域,检测模型的一致性和和可重复性至关重要。在该研究中,研究团队开发了一种新型的3D培养技术(NACs技术),使用DNA折纸纳米结构(NAC-Linkers)促进细胞间连接的形成,从而制备具有高度一致性的3D培养模型。与传统依赖细胞自然粘附的方式不同,NACs技术通过DNA纳米结构的引导,加速了细胞的自组装过程,在24小时内即可完成3D模型的构建。NAC-Linkers具有极高的生物相容性,在介导细胞组装时不会干扰细胞的正常生物学活动,也不会触发免疫反应,保证了3D模型的生物学功能和药物筛选的准确性。同时,NACs技术还突破了传统技术在细胞数量上的限制,支持高达百万细胞数量级的模型建模。该方法可以进一步扩展,构建更复杂的组织结构。利用NAC-Linkers介导的细胞空间异质性分布,可以精确地排列不同类型的细胞,形成特定的空间分布结构,从而重现组织水平的细胞间相互作用。这一开创性方法具有显著的潜力,可推动体外组织建模的发展,对提高药物筛选的效率和准确性、推动个性化医疗的发展具有重要意义,同时也为研究细胞间相互作用和疾病进程提供了新的视角和工具。
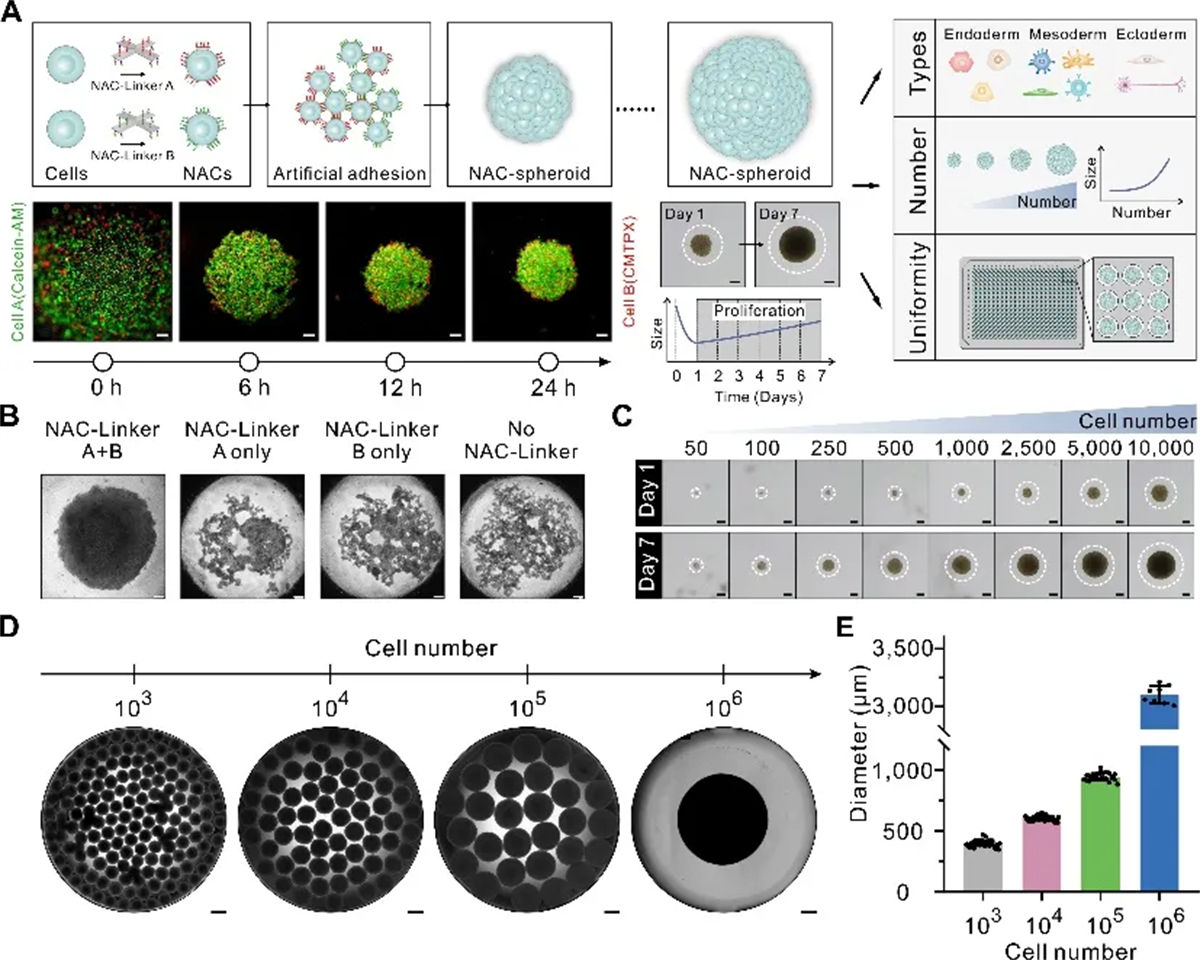
图1 通过 NACs技术实现3D细胞球标准化构建
基于NAC-Linkers构建的类肝微组织具有高效且均一的特征
利用NACs技术,研究团队将肝组织内多种类型的细胞(肝窦内皮细胞(LSECs)、肝星状细胞(HSCs)和Kuffer细胞)重组为3D肝微球(NAC-Liver)。基于 NAC-Linkers 构建的肝微球具有高效且均一的特征,且在功能上展现出了与肝组织高度的相似性。能够高水平维持肝脏合成和代谢功能,维持乙型肝炎病毒受体牛磺胆酸共转运多肽(NTCP)的表达。此外,NAC-Liver对化合物肝脏毒性反应敏感,能够更准确地评估药物的安全性。
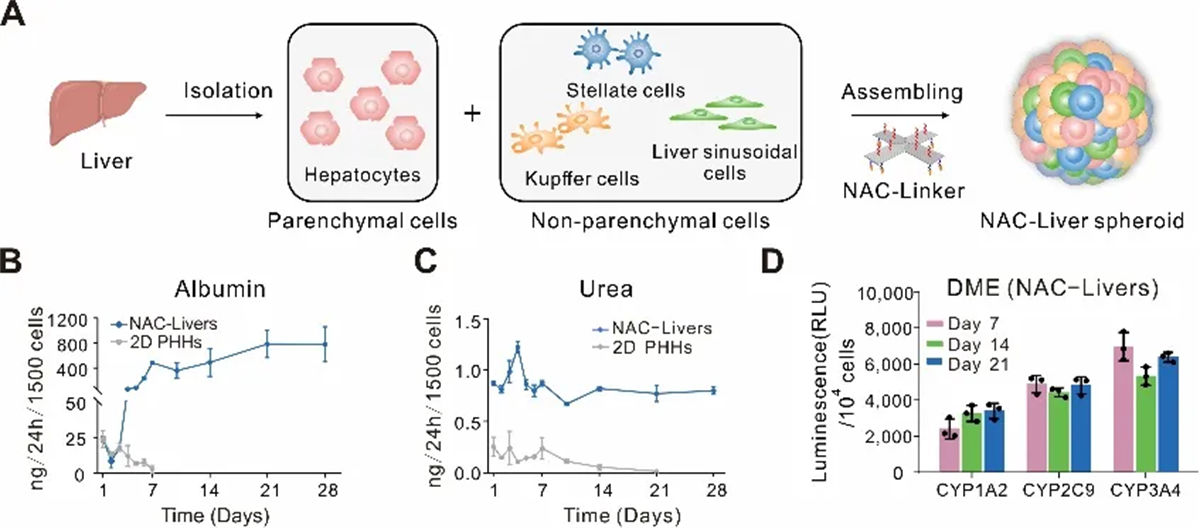
图2 通过NACs技术构建的肝微球可表达正常肝组织功能
GalNAc系统是高效的肝细胞靶向递送系统,已经成为开发小核酸药物的重要手段,但是冻存够的原代肝细胞中ASGPR受体活性的显著下降,阻碍了对GalNAc系统递送效率的准确评估。NAC-Liver能够提高肝细胞对GalNAc的摄取效率,解决了原代肝细胞复苏后ASGPR受体活性下降的问题。研究团队使用针对补体5(C5)的GalNAc-siRNA药物(Cemdisiran)进行了验证,发现NAC-Liver能够更高效的摄入Cemdisiran。进而抑制C5表达、改善肝细胞脂肪变性。该研究结果,突出了NACs技术在恢复细胞功能性方面的潜力,为评估和优化药物递送系统提供了新的工具,有助于精确测量药物的摄取、细胞内运输和治疗效果。
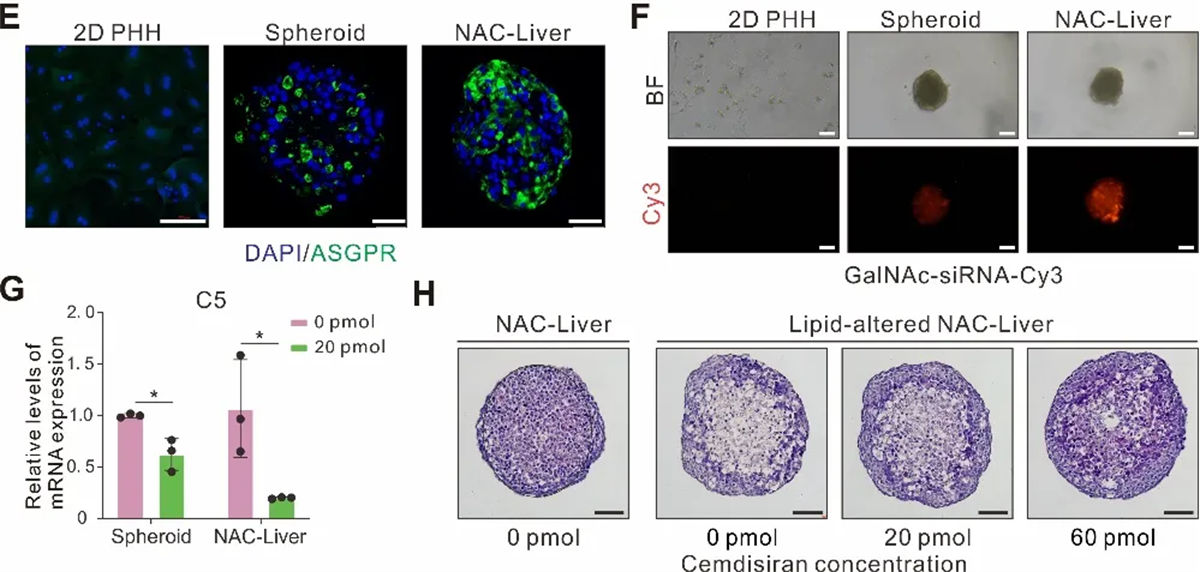
图3 重塑药物递送与细胞功能性评估
NACs技术在3D病理模型构建中的创新应用
NACs技术在3D疾病模型构建上取得了突破性进展,特别是在模拟慢性病方面。肝纤维化作为典型的慢性疾病由于其复杂的多阶段特性,对3D体外模型的构建提出了巨大挑战。研究团队通过调控星状细胞的特征性空间分布,构建了一步法混合模型(mixNAC-Liver,简写为 mNAC-Liver)及具有“核-壳结构”的分步法包被模型(package NAC-Liver,简写为 pNAC-Liver)并验证了直接纤维化诱导及高脂环境培养两种方式均可诱导慢性病病理表型的产生。其中 mNAC-Liver 呈现出临床肝病早期的生化及病理特征,而pNAC-Liver 则更接近于进展期慢性肝病的生化及病理特征。基于这两个模型,研究团队复现了非酒精性脂肪性肝病(Non-alcoholisteatohepatitis, NASH)进展不同阶段,两种模型对 NASH 潜在治疗小分子 GFT505 呈现出不同的疗效,模拟进展期慢性肝病的pNAC-Liver 的纤维化及炎症改善显著弱于模拟早期肝病的 mNAC-Liver。该结果与临床实验中 GFT505在NASH 疾病早期(纤维化水平F1-2)及疾病进展期(纤维化水平F2-3)患者体内的差异疗效相符,提示精确细胞的空间分布模型能够更精准的预测药物在慢性疾病不同进展阶段的药效。
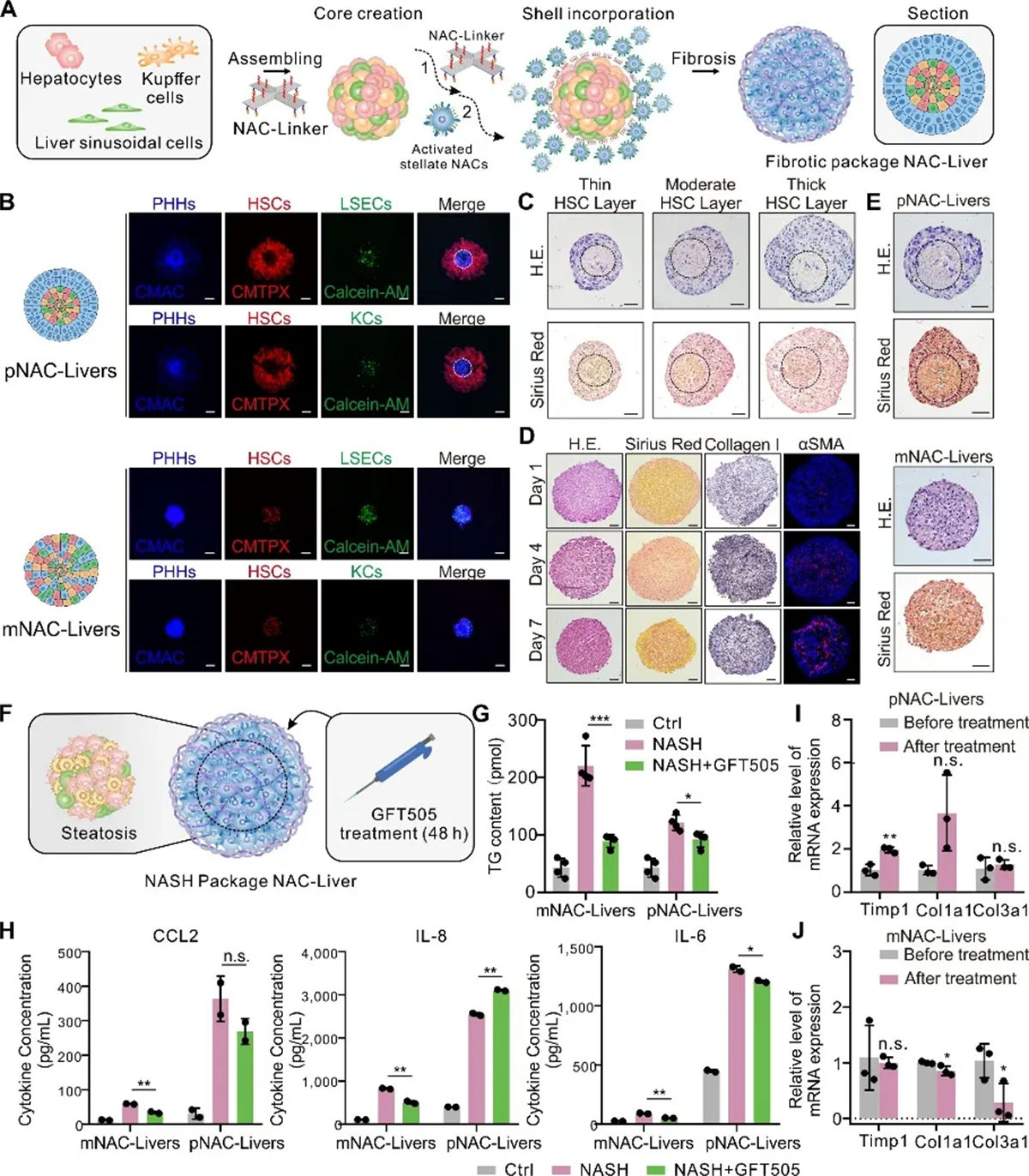
图4 利用NACs技术构建慢性肝病三维模型
揭秘免疫微环境,开辟疾病治疗新路径
在生物医学的领域中,免疫微环境的研究正成为解锁疾病治疗新策略的关键。NACs技术为模拟免疫细胞与组织的相互作用提供了新的思路。基于NACs技术,研究团队构建了两种模型,以精确模拟免疫细胞与特定组织/器官的相互作用。通过免疫细胞与肝组织细胞共组装形成的“组装型免疫微环境模型”重现了肝脏的免疫微环境。对组装型免疫微环境模型进行药物(对乙酰氨基酚)损伤实验,发现巨噬细胞在减轻药物引起的肝脏损伤中发挥了保护作用。
通过将循环免疫细胞引入培养体系,成功模拟了肿瘤微环境和免疫细胞侵入过程。这一模型不仅再现了肿瘤免疫相互作用,还能够对免疫治疗药物的药效进行评估。在使用免疫治疗剂BLZ945处理后,巨噬细胞的侵入显著减少,通过qPCR分析确认了药物在促进巨噬细胞向抗肿瘤M1表型转变的能力。
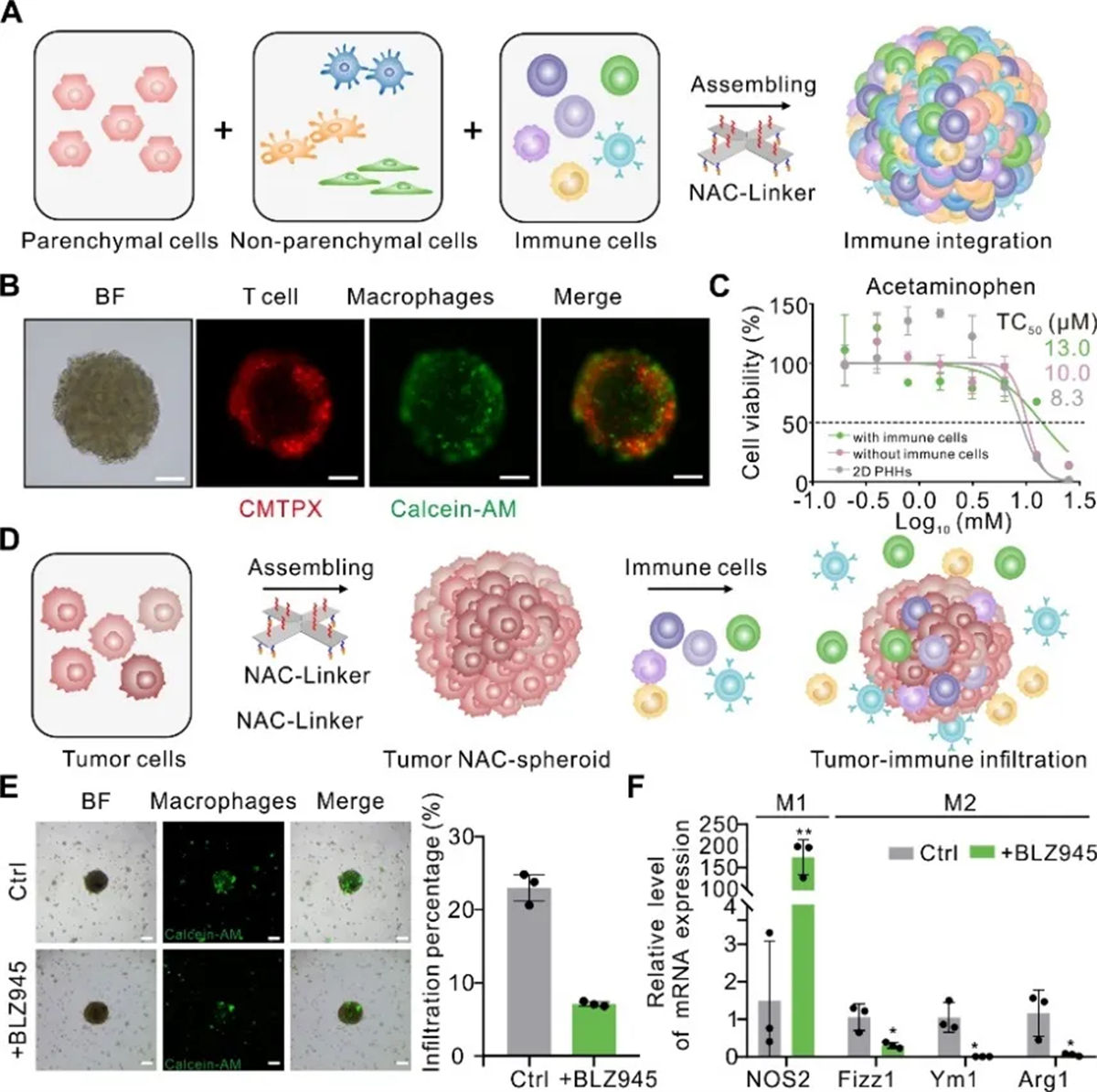
图5 构建三维肿瘤免疫微环境模型
NACs技术下的高通量药物筛选
在药物筛选的方面中,NACs技术能够为高通量药物筛选提供高效、低成本的研发工具,NACs技术无需复杂设备即可实复杂3D模型的标准化、规模化生产。
在该研究中,研究团队通过肝纤维化模型验证了NACs模型在药物研发中的有效性。首先,利用肝纤维化NACs模型和小鼠模型确定了以PDK1作为抗纤维化开发靶点。随后,利用AI技术从FDA批准的药物库中筛选出具有高亲和力的分子候选物,进一步在NACs肝纤维化模型上进行了高通量验证。通过高内涵成像技术对候选药物的抗纤维化效果和潜在肝毒性进行了高效评估,最终发现了具有显著抗纤维化效果的axitinib。从目标识别到高通量筛选,基于NACs技术的高通量药物筛选平台在30天内即实现了药物的快速开发,展现了3D模型在药物筛选中的高效性和准确性。
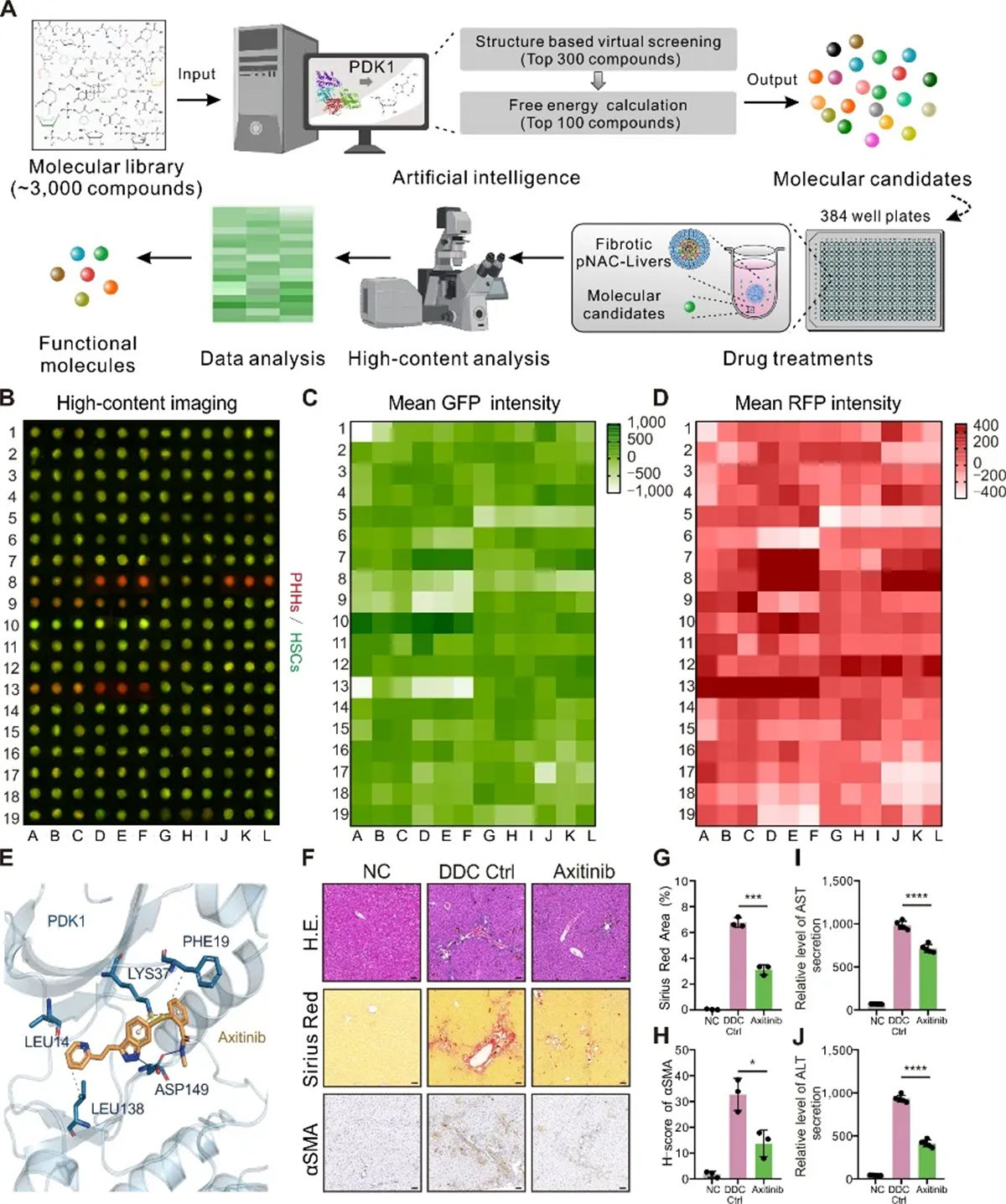
图6 基于AI+BT模式开展高通量药物筛选
使用NACs技术开发的新型疾病模拟及药物筛药平台能够作为体内研究前的预筛选步骤,极大缓解目前大批量动物实验用于临床前药物研发的经济及时间困境。该研究着重关注慢性肝病发展的中间阶段,特别是肝纤维化的早期阶段,以找到早期干预的最佳时机。这有望提供可靠的工具来评估潜在治疗方法的有效性,从而防止慢性肝病的进一步发展,为药物研发及安全窗评估提供新的、可靠的筛选工具。
