上海市浦东新区蔡伦路780号8层810室
新闻动态
文献分享 | 利用人脑类器官培养乳腺癌脑转移模型
恶性肿瘤的转移往往是肿瘤治疗失败的主要原因,了解其分子和细胞机制有助于开发有效疗法。近日,辛辛那提儿童医院郭子元博士在《Breast Cancer Research》(IF=6.1)发表题为《Utilizing human cerebral organoids to model breast cancer brain metastasis in culture》的论文,该文介绍了一种利用人胚胎干细胞衍生的大脑类器官与人类乳腺癌细胞系共培养来研究乳腺癌脑转移(BCBM)的新模型,该模型有助于阐明乳腺癌细胞在脑转移过程中与肿瘤微环境(TME)的相互作用。在这篇文章中,我们将分享这项意义重大的研究,探讨它是如何通过模拟肿瘤微环境,为我们提供对抗肿瘤转移的新思路和方法。让我们一起深入了解这项研究的发现,以及它对未来肿瘤治疗可能带来的影响。

研究人员首先在2D模型上将人类星形胶质细胞分别与GFP标记的人类乳腺癌细胞系共培养,包括MDA-MB-231、MCF-7和HCC-1806,结果显示三种癌细胞系均能在星形胶质细胞上形成集落。随后研究人员使用改良共培养3D模型来模拟肿瘤细胞侵袭过程,结果显示MDA-MB-231能在类器官中形成肿瘤克隆,而MCF-7和HCC-1806细胞系未形成明显克隆。
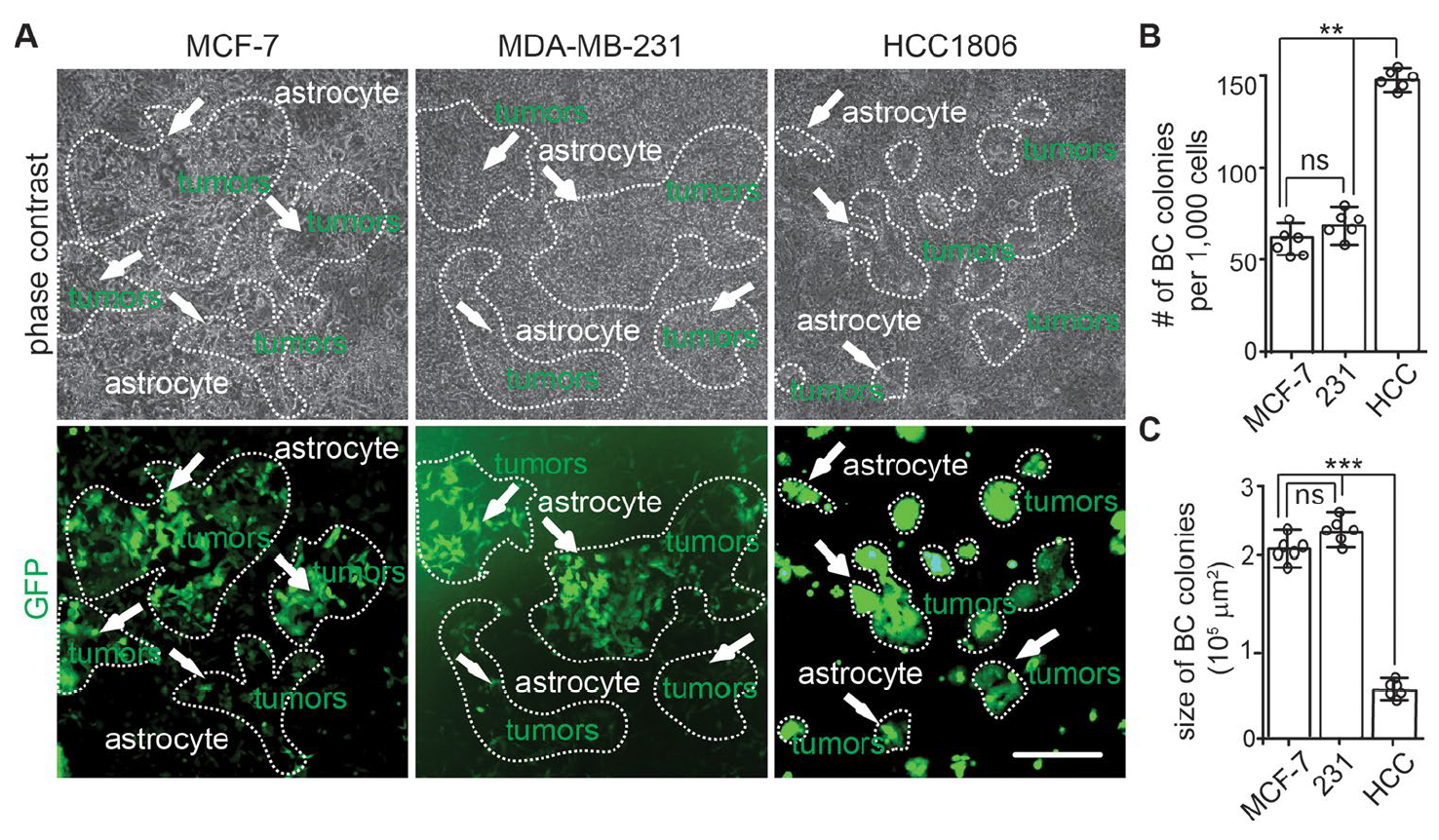
图1:2D模型共培养
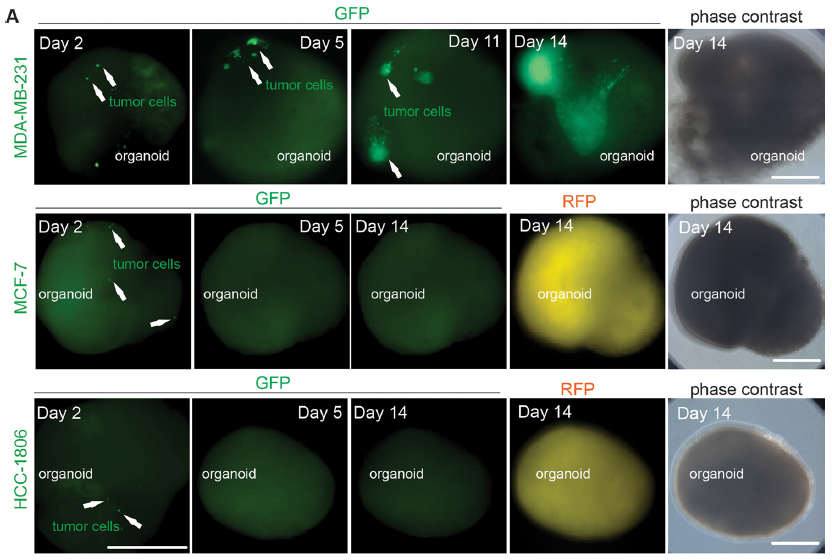
图2:3D模型共培养
为了进一步探究乳腺癌与脑类器官的特性,作者通过免疫染色分析乳腺癌细胞在大脑类器官中的增殖情况,发现MDA-MB-231和SUM159PT细胞在类器官中增殖并定植于TUJ1 阳性的神经元区域,并且能增强周围星状细胞GFAP表达,TUNEL检测发现MDA-MB-231和SUM159PT细胞存在凋亡现象,而MCF-7和HCC-1806细胞增殖较少。
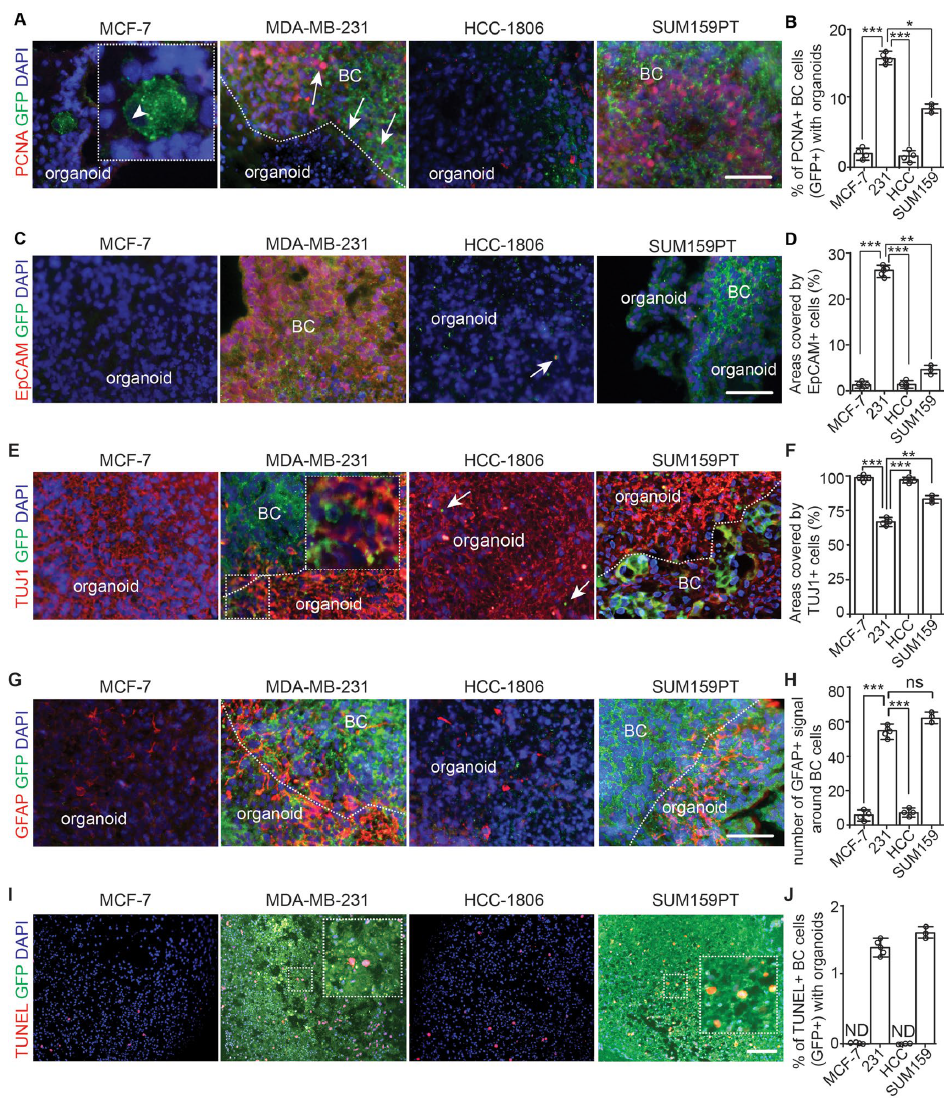
总结
创新点总结
在本文中,作者开发了一种新型的三维共培养模型,使用hESC衍生的大脑类器官与人类乳腺癌细胞系共同培养,以模拟乳腺癌细胞在大脑中的微环境。这一模型首次允许研究者在体外条件下深入观察和分析乳腺癌细胞与大脑神经细胞之间的相互作用,从而为理解乳腺癌脑转移的机制提供了新的视角。此外,该模型能够区分不同乳腺癌细胞系在类器官中的侵袭和增殖能力,为识别新的治疗靶点和开发针对性治疗策略提供了科学依据。通过这种共培养系统,研究人员能够模拟人类肿瘤微环境,提高了实验结果的临床相关性,为个性化医疗和精准治疗乳腺癌脑转移开辟了新的方向。
研究局限性及未来研究方向
该文作者提到,类器官的构建成本较高,技术要求复杂,并且需要较长的时间来分化出神经细胞类型。其次,尽管类器官提供了一个3D的微环境模型,但在模拟肿瘤微环境的复杂性方面仍有提升空间。同时,由于类器官的培养条件和遗传背景可能存在差异,这可能影响实验结果的一致性和在不同研究之间的普适性。
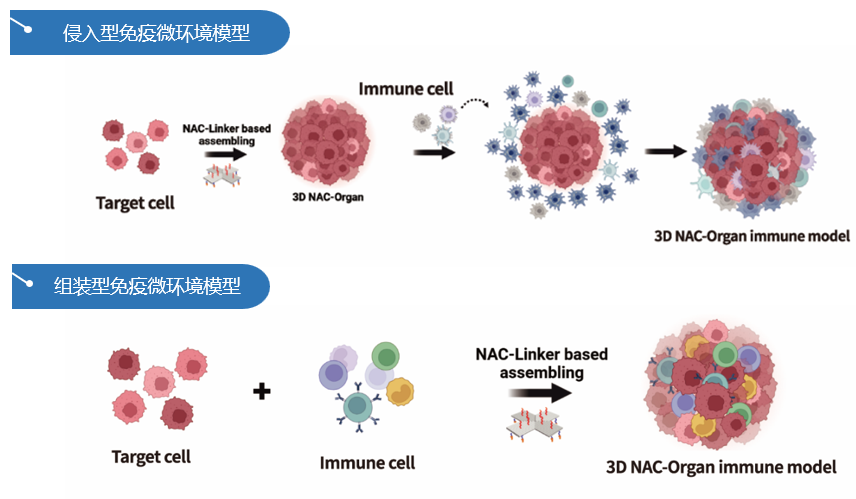
朴衡博迈独家研发的全球首个基于纳米核酸材料的3D建模技术—NAC-Organ技术,利用合成生物学技术开发的NAC-Linker分子胶水,介导细胞在三维空间高效自组装,实现细胞类型、数量和空间分布的精准调控。NAC-Organ技术直接选用成熟的原代细胞进行3D培养,不依赖于干细胞的分化、增殖,实现对细胞数量、分布的控制,构建出的模型具有高度的重复性和均一性。
基于NAC-Organ技术,朴衡可以通过两种方式完成肿瘤免疫微环境模型的构建:1)侵入型免疫微环境模型:在肿瘤模型构建完成后,加入免疫细胞。由于NAC-Organ技术在建模的过程中无需基质胶支撑,免疫细胞能够自由侵入NAC-Organ模型内部,形成侵入型免疫微环境模型。2)组装型免疫微环境模型:利用NAC-Organ技术将免疫细胞与目的细胞组装,构建肿瘤细胞与免疫细胞共培养的3D免疫微环境模型。
朴衡拥有成熟的类器官构建经验,利用NAC-Organ技术,朴衡可在体外构建不同类型肿瘤细胞对不同组织类器官的转移侵袭模型,该模型弥补了传统2D细胞培养的种属差异及肿瘤微环境缺失,可动态监测肿瘤细胞的转移过程,探索或验证肿瘤转移过程中涉及的分子机制。朴衡类器官肿瘤迁移模型可作为药物测试平台,评估药物对肿瘤细胞侵袭性和扩增能力的作用,为个性化医疗和精准治疗提供科学依据。