上海市浦东新区蔡伦路780号8层810室
新闻动态
文献解读 | 探索肿瘤微环境的奥秘:3D类器官模型引领肿瘤研究新纪元
当代肿瘤治疗研究的一个关键领域是深入理解肿瘤免疫微环境(TME)的复杂性,并探索如何利用这一环境来开发更有效的免疫治疗策略。近日,斯坦福大学Calvin J. Kuo教授在《Nature reviews cancer》(IF = 72.5)发表综述“Cancer organoids 2.0: modelling the complexity of the tumor immune microenvironment”。本文主要综述了肿瘤类器官在模拟肿瘤免疫微环境的复杂性的方法,以及如何能够通过这种复杂模型精准模拟肿瘤的生物学特征以及预测免疫治疗疗效。

类器官是干细胞衍生的3D培养物,自组织成体外的“迷你器官”,并概括了其体内对应来源组织/器官的各层面功能与结构特征。与固定样本的静态、单时间点特征描述相比,患者来源的肿瘤类器官(Patient-derived Organoid, PDO)允许对肿瘤生物学进行功能性动态建模和研究。与二维细胞系相比,类器官的优势包括:更高的培养成功率、能够生成同一患者匹配的正常类器官和肿瘤类器官配对、更好地保留原始肿瘤特征和患者间变异性、保留原始肿瘤结构和遗传完整性、能够长期培养及构建生物样本活库。然而,传统的肿瘤类器官模型往往未能保留包括免疫细胞、基质细胞在内的成分,而与这些细胞相关的相互作用与肿瘤发生、生长、进展以及对治疗等外部影响的响应密切相关。虽然针对这类肿瘤类器官的研究已经产生了大量的重要见解,但由于其局限性,学界迫切需要包含多种TME成分的、更复杂的类器官系统来对癌症生物学进行全面建模与研究。
为了克服这些挑战,研究者们开发了一种新型的3D肿瘤类器官模型,这种模型能够更真实地模拟肿瘤的生物学特性和TME的复杂性,为研究肿瘤生物学和评估药物反应提供了一个更加精准的平台。这些系统通过将肿瘤细胞与免疫细胞共培养,模拟了TME中的细胞间相互作用。
类器官是干细胞衍生的3D培养物,自组织成体外的“迷你器官”,并概括了其体内对应来源组织/器官的各层面功能与结构特征。与固定样本的静态、单时间点特征描述相比,患者来源的肿瘤类器官(Patient-derived Organoid, PDO)允许对肿瘤生物学进行功能性动态建模和研究。与二维细胞系相比,类器官的优势包括:更高的培养成功率、能够生成同一患者匹配的正常类器官和肿瘤类器官配对、更好地保留原始肿瘤特征和患者间变异性、保留原始肿瘤结构和遗传完整性、能够长期培养及构建生物样本活库。然而,传统的肿瘤类器官模型往往未能保留包括免疫细胞、基质细胞在内的成分,而与这些细胞相关的相互作用与肿瘤发生、生长、进展以及对治疗等外部影响的响应密切相关。虽然针对这类肿瘤类器官的研究已经产生了大量的重要见解,但由于其局限性,学界迫切需要包含多种TME成分的、更复杂的类器官系统来对癌症生物学进行全面建模与研究。
为了克服这些挑战,研究者们开发了一种新型的3D肿瘤类器官模型,这种模型能够更真实地模拟肿瘤的生物学特性和TME的复杂性,为研究肿瘤生物学和评估药物反应提供了一个更加精准的平台。这些系统通过将肿瘤细胞与免疫细胞共培养,模拟了TME中的细胞间相互作用。
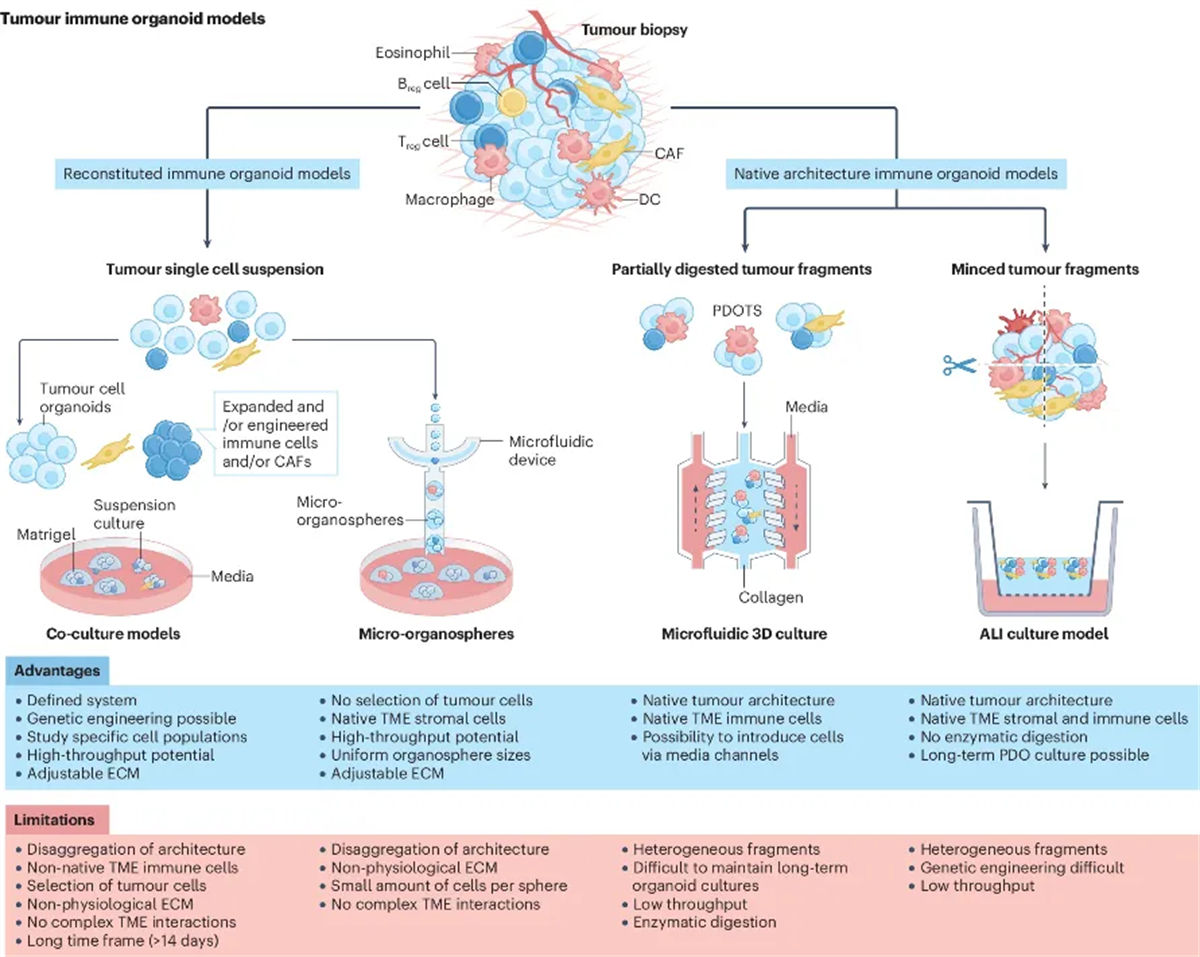
图1 肿瘤免疫类器官模型概述
在精准医疗领域,肿瘤类器官模型的应用前景尤为广阔。通过从患者体内直接获取肿瘤组织并建立类器官,研究者能够评估特定患者对特定治疗的反应,从而为每位患者提供个性化的治疗方案。这种个体化的评估方法有望显著提高治疗的有效性,并减少不必要的副作用。
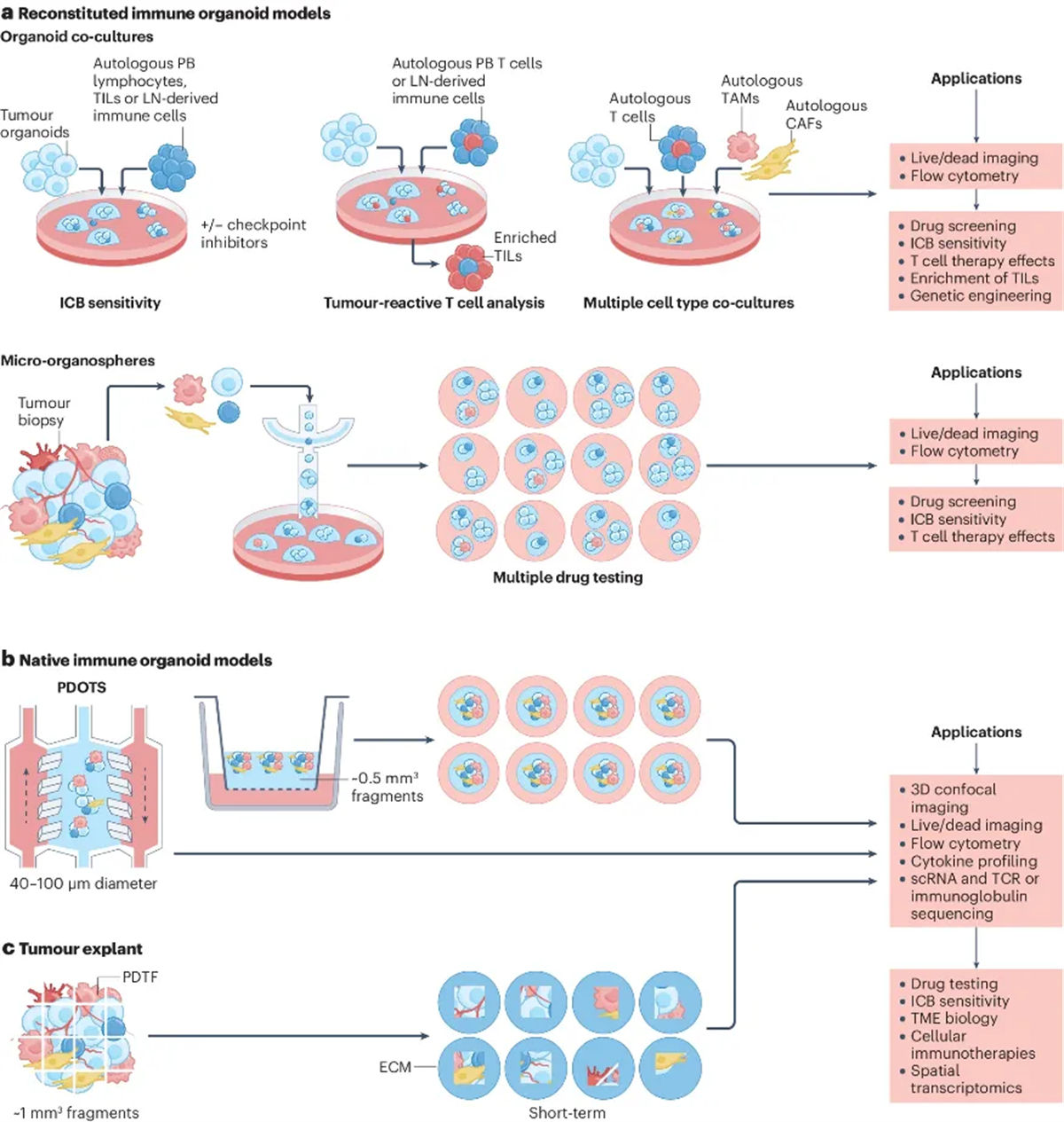
图2 肿瘤免疫类器官作为转化治疗模型
尽管肿瘤免疫类器官模型在模拟TME和评估免疫治疗方面展现出巨大潜力,但作者也指出了当前模型面临的挑战和局限性。首先,肿瘤是由多种细胞类型组成的异质性群体,而当前的类器官模型可能无法完全复制原始肿瘤的这种复杂性和异质性。此外,在类器官中进行基因编辑和操作可能比在2D细胞培养中更为复杂,尤其是当需要在包含多种细胞类型的类器官中进行特定细胞类型的基因操作时。最后,类器官技术的复杂性和成本可能限制了它们在常规临床实践中的应用。
朴衡博迈独家研发的全球首个基于纳米核酸材料的3D建模技术—NAC-Organ技术,利用合成生物学技术开发的NAC-Linker分子胶水,能够介导细胞在三维空间高效自组装,实现细胞类型、数量和空间分布的精准调控。仅需24小时即可完成体外3D模型的构建。可根据需求引导来自不同胚层的多种细胞进行组装,更精准的模拟人体器官的真实细胞组分构成,实现复杂慢性疾病、免疫微环境等体外复杂3D模型的开发。
利用NAC-Organ技术将免疫细胞与目的细胞组装,构建肿瘤细胞与免疫细胞共培养的3D免疫微环境模型(图3)。NAC-Organ技术可以整合原肿瘤病灶内的免疫细胞,造模时间短,免疫细胞活性高,并且体外培养方便补充外源免疫细胞进行免疫疗法药物的评价,成本低且操作简单,更有利于进行肿瘤药物检测(图4)。
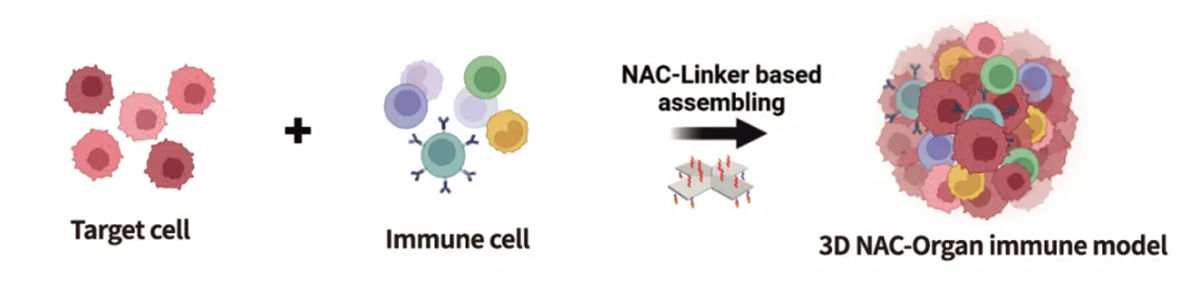
图3 组装型肿瘤免疫微环境模型构建示意图
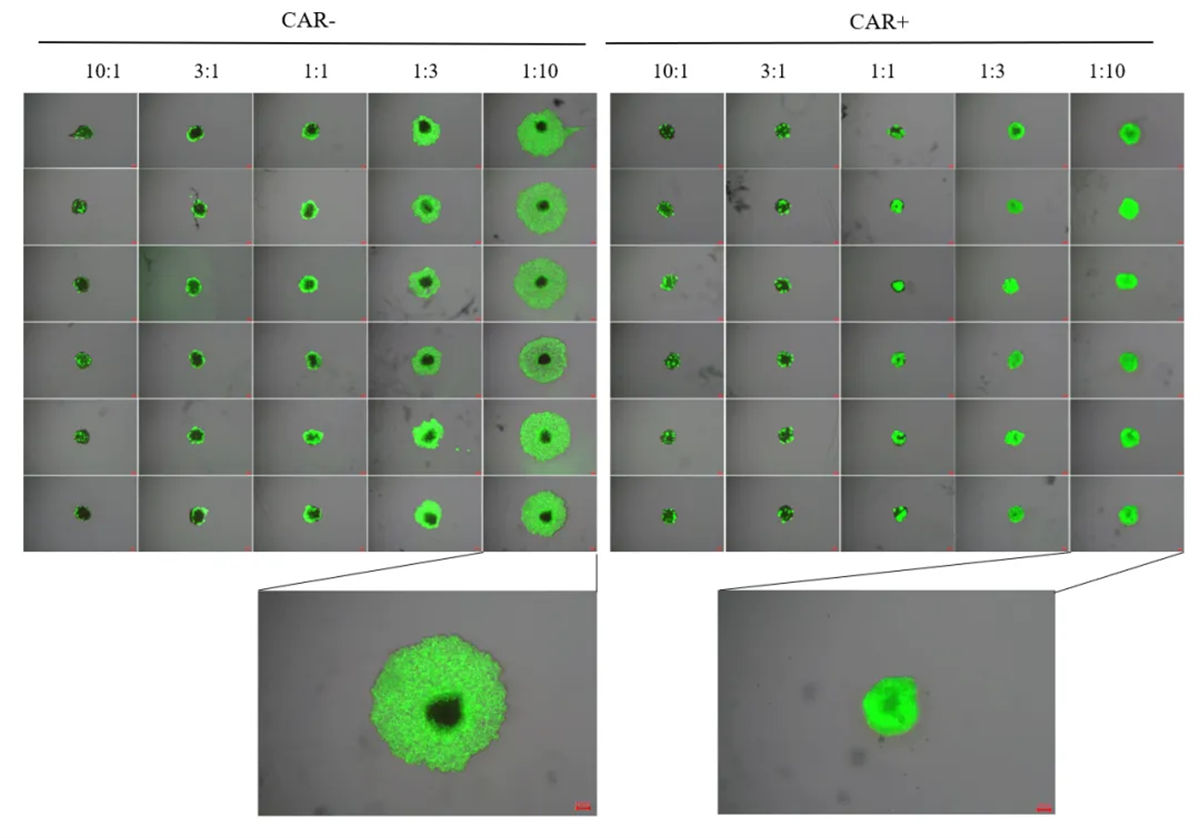
图4 TME模型监测CAR-/+Macrophage(绿色)细胞靶向、侵入模型瘤体的能力[1]。
此外, NAC-Organ技术构建3D模型无需基质胶支撑,免疫细胞能够自由侵入NAC-Organ模型内部,形成侵入型免疫微环境模型(图5)。基于该模型可实时观测到免疫细胞对肿瘤侵入、浸润、杀伤的过程(图6)。
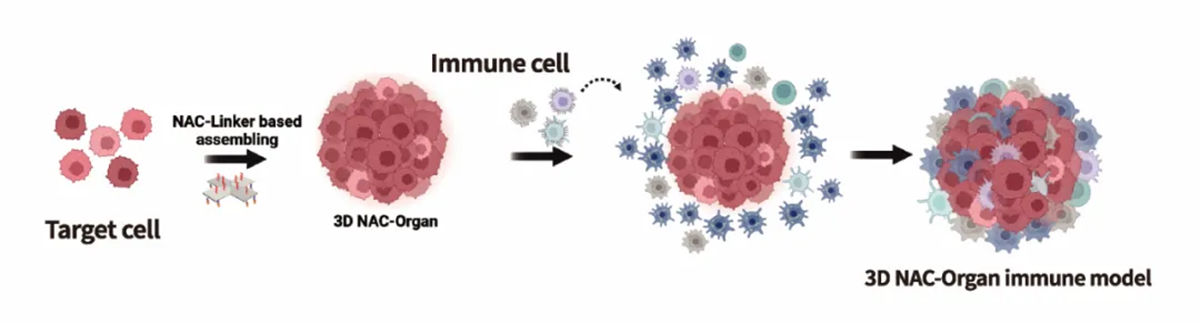
图5 侵入型免疫微环境模型构建示意图
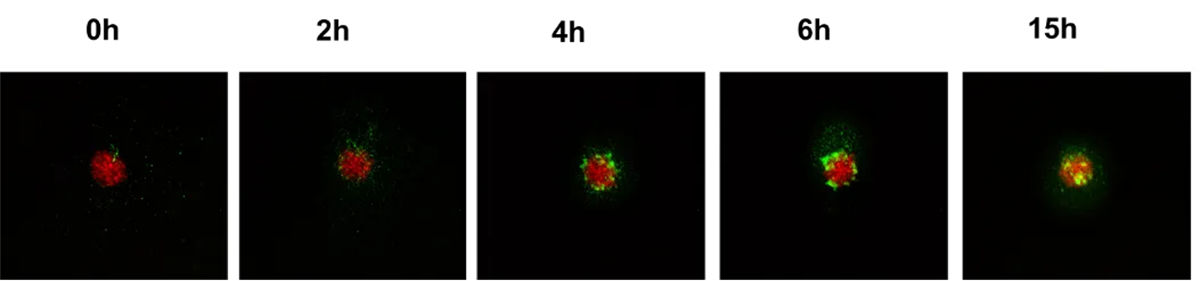
图6 不同时间PBMC侵入实体肿瘤
参考文献
[1]Pei H, Wei J, Sun Y, et al. Designer Cellular Spheroids with DNA Origami for Drug Screening[J]. 2023.10.21203/rs.3.rs-3555194/v1
