Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
News Center
再生治疗突破性进展 | 人-猪异种嵌合肾脏
器官移植在治疗终末期疾病中发挥着重要作用,但供体匮乏和免疫排斥限制了其广泛应用。据不完全统计,我国每年开展器官移植手术的患者2万多例,而因终末期器官功能衰竭等待移植的患者高达30万,供需缺口巨大。异种嵌合人源化器官和体外三维培养器官被认为是最有希望能解决这一世界性难题的新型技术。近期,利用异种嵌合技术在动物体内生产人源化供体器官取得了重大突破中国科学院广州生物医药与健康研究院赖良学研究员、戴祯研究员及其课题组在国际权威学术期刊《Cell Stem Cell》发表题为《Generation of a humanized mesonephros in pigs from induced pluripotent stem cells via embryo complementation》的论文。该文报道了研究人员利用新型人诱导多能干细胞,结合优化的胚胎补偿技术体系,首次在肾脏缺陷猪模型体内培育出人源化肾脏。这是世界范围内首次报道的人源化功能性器官异种体内再现的案例。
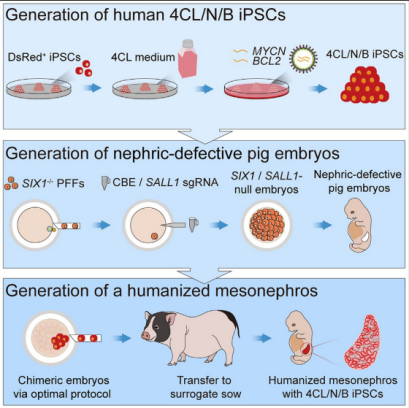
在该研究中,研究团队对人多能干细胞(iPSC)进行了改造。通过表达促生存基因MYCN和BCL2,可以暂时关闭细胞凋亡程序,从而极大地增强了人多能干细胞的竞争能力。并利用一种新型培养基,使得人多能干细胞可以回到更早期的发育阶段,显著提升了跨物种嵌合的效率。同时,研究团队通过基因工程敲除两个基因:SIX1/SALL1,使得缺失的猪胚胎将产生肾脏的生态位空缺,表现为中肾发育缺陷、后肾缺失。该研究最终共获得2只胎龄25天、3只胎龄28天的中肾嵌合胎儿。这些嵌合胎儿的中肾内人源细胞占比最高可达70%,而人源细胞参与形成的中肾小管所占比例最高可达58%。
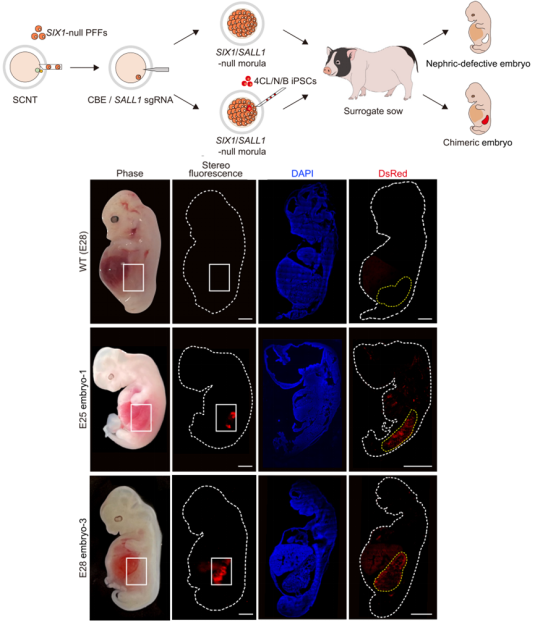
该文通讯作者戴桢研究员表示:针对肾脏发育关键功能性基因SIX1、SALL1、PAX2及WT1的免疫荧光染色结果证明,人源供体细胞已分化成为表达这些基因的功能性细胞,说明伴随着胚胎发育,肾脏缺陷猪胎儿体内的人源供体细胞将能够支持人源化肾脏生成。同时戴桢研究员强调了该项技术在伦理方面的安全性:我们在生殖嵴(胚胎发育至4-5周时,在体腔背面肠系膜的基底部两侧,左右两侧各出现两个由体腔上皮增生所形成的隆起,统称为泌尿生殖嵴)中没有发现人细胞,这表明人类多能干细胞没有分化成生殖细胞。
由于器官大小与人类接近,长期以来猪一直被认为是制备人类供体器官的最佳物种,该研究首次在猪中实现了人源化肾脏的定向嵌合,为异种嵌合器官技术的发展提供了重要的支持。
该文通讯作者戴桢研究员是朴衡科技的专家团队成员,在开发异种嵌合器官技术的同时,也与朴衡团队共同开发体外三维培养器官移植再生技术。NAC-Organ技术能够在体外三维器官中引入血管发育系统、促分化系统,建立高效定植的3D移植物。相比传统的干细胞移植治疗能够实现更有效的组织内定植,更高效的修复组织损伤。是研究组织再生治疗修复的有力工具。目前已经实现多个组织、器官的移植再生治疗验证。

- Previous article:NAC-Organ技术助力慢性肝损伤新机制研究
- next:免疫炎症新药发现-靶点与技术研讨成功举办!
