Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
News Center
琥珀酰化修饰异常|多组学分析揭示抗新冠病毒新靶点
近期,奥密克戎亚型毒株BA.4和BA.5再掀全球疫情高潮。由于此前多国相继取消疫情限制,且该两种毒株具有更强的传播能力,欧美亚洲等多国的新冠感染人数急剧上升。尽管目前已有多种预防治疗手段,如新冠疫苗、中和抗体药物等,但是对于精准深入地研究新冠病毒及其感染宿主细胞的生物学特性和研发经济有效的新冠特效药物仍是当今全世界迫在眉睫的挑战。
2022年7月13日,中国农业科学院长春兽医研究所金宁一院士、广东省农业科学院廖明教授、中国农业科学院长春兽医研究所李昌研究员、长春中医药大学赵翊丞教授团队在国际权威期刊PNAS上在线发表了题为The global succinylation of SARS-CoV-2-infected host cells reveals drug targets 的最新研究成果,研究团队通过功能多组学 (蛋白质组、琥珀酰化修饰组学及转录组) 的系统研究,首次发现并揭示了琥珀酰化修饰在新冠病毒感染中的作用,并发现了潜在的治疗药物。朴衡科技深度参与了该研究的大数据分析以及多组学分析相关的工作。
多组学分析是系统全面地解析生物分子功能和调控机制的重要手段,并通过分析组学数据使研究人员对SARS-CoV-2病毒感染宿主的过程有了更深的理解和认识。蛋白翻译后修饰(post-translational modification, PTM) 的研究不但能够确定蛋白的乙酰化,磷酸化等修饰水平,亦能为研发潜在药物的作用机制提供新的思路。因此,作为一种新发现的PTM,琥珀酰化不但能够引发更多蛋白质特性的改变,并且琥珀酰基团由于空间结构较大,因此对于蛋白质结构和功能会产生更为显著的影响[1]。

研究以新冠病毒SARS-CoV-2侵染Caco-2细胞为模型,对感染细胞进行了蛋白组、琥珀酰化修饰组及转录组学分析,该研究结果发现宿主蛋白质在感染时间过程中大量减少,因病毒可以抑制宿主mRNA的输出和翻译。在该研究中发现于24 hpi时琥珀酰化修饰蛋白的丰度显著上调,共鉴定1,000个琥珀酰化蛋白及2,142个琥珀酰化修饰位点。因此,蛋白质琥珀酰化修饰可能为SARS-CoV-2感染期间的重要宿主反应,并且可能在病毒复制过程中发挥调节作用。
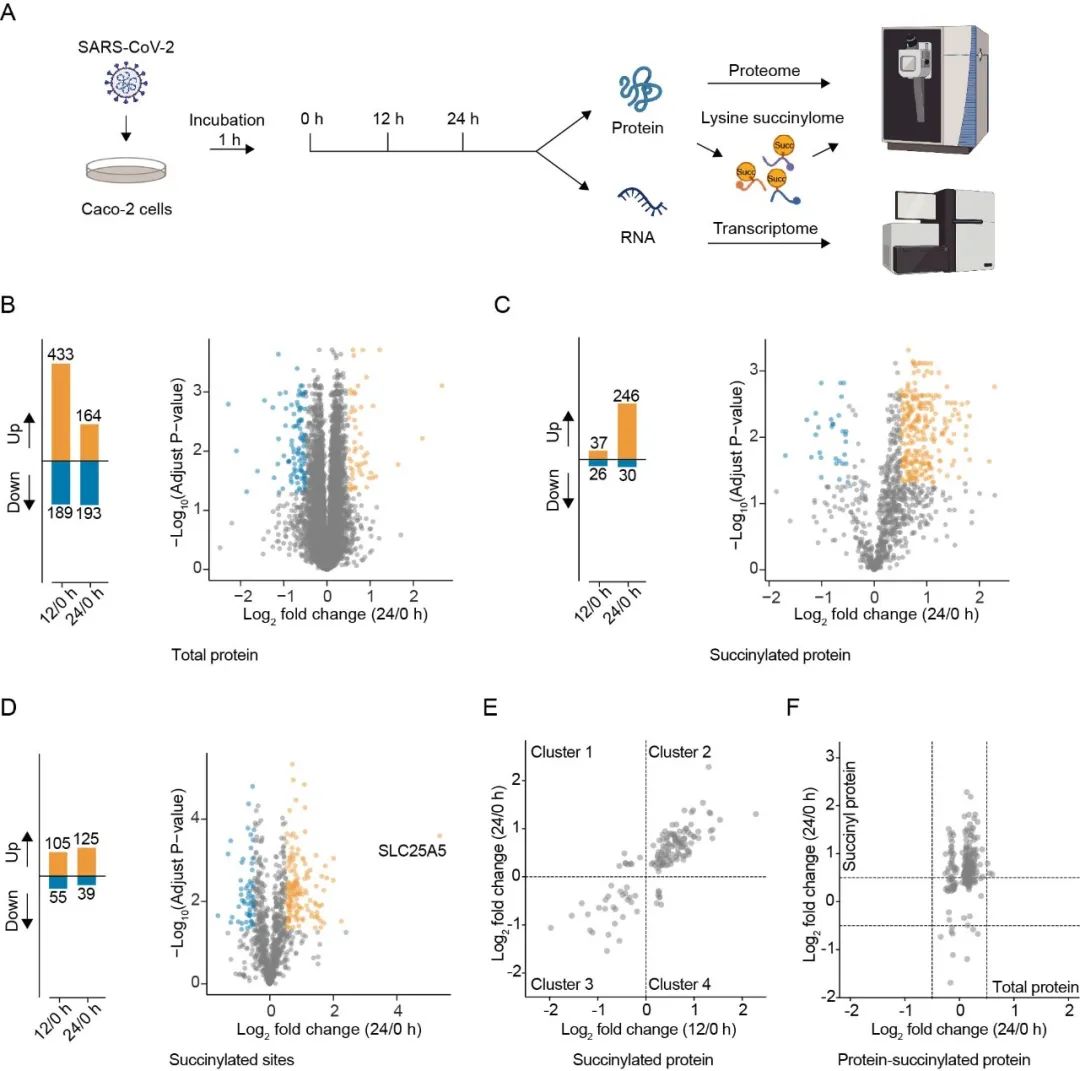
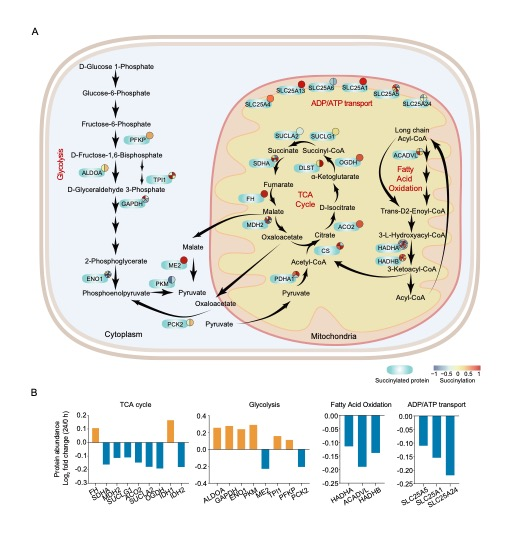
随后,通过生信研究分析SARS-CoV-2感染可促进宿主细胞关键代谢途,如TCA循环、糖酵解、脂肪酸氧化和线粒体转运等相关酶的琥珀酰化。特别值得关注的是代谢限速酶OGDH和IDH1的活性因琥珀酰化会发生显著下降,同时抑制了细胞自身增殖,这可能有助于加强病毒的复制及对宿主能量来源的摄取。该研究还发现敲除去琥珀酰化酶SIRT5可以提高TCA相关代谢酶 (MDH2、SDHA和OGDH) 的琥珀酰化水平,会导致相关酶失活,并抑制细胞的增殖。
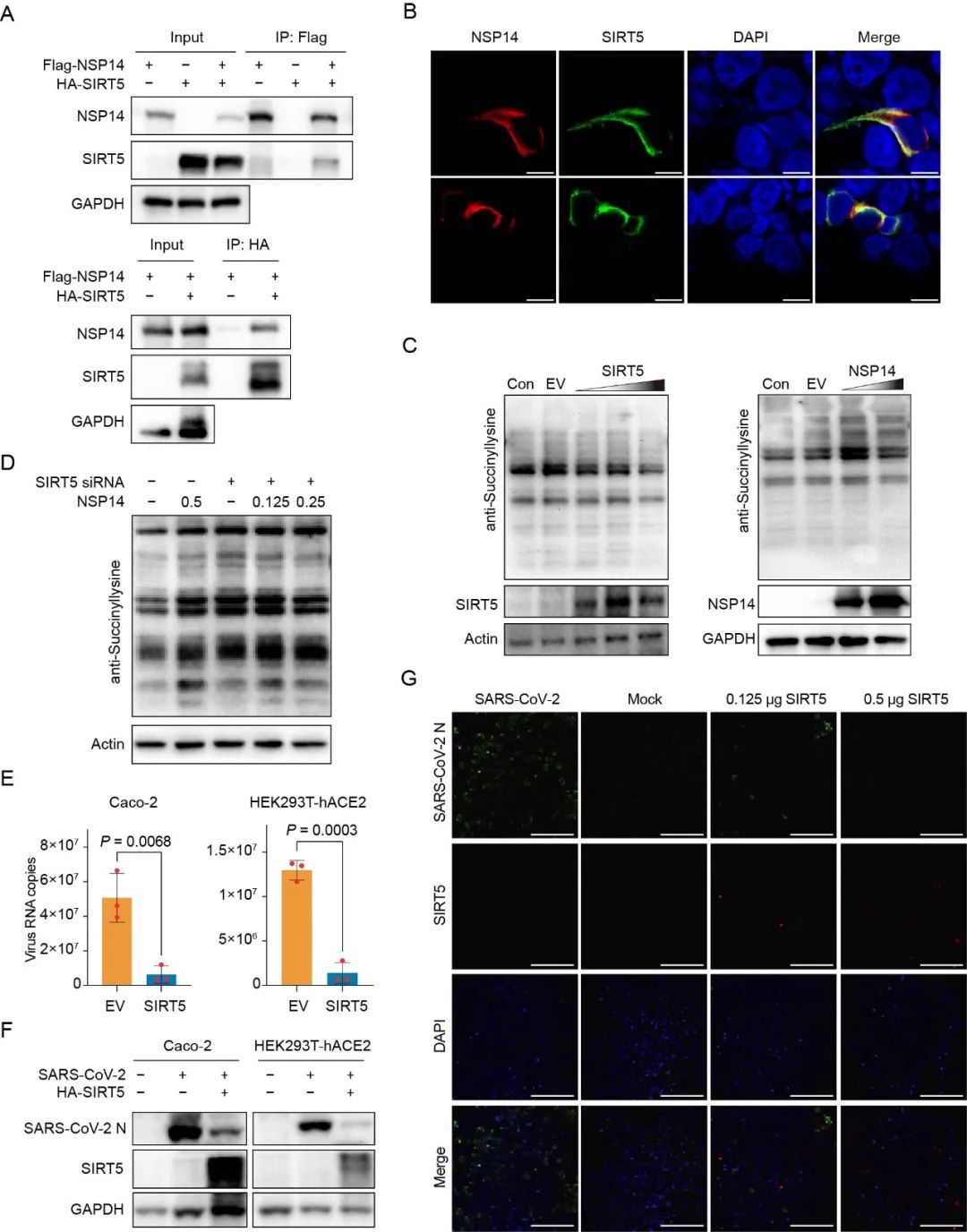
该团队通过对SARS-CoV-2与宿主互作蛋白组进一步的分析,发现病毒的NSP14蛋白可以与SIRT5相互作用从而促进宿主蛋白的琥珀酰化水平,并在体外试验验证了由SIRT5诱导的抑制宿主蛋白琥珀酰化水平可以有效地抑制病毒的复制。
最后,探究以琥珀酰化酶、去琥珀酰化酶或高琥珀酰化蛋白为目标的12个直接或间接的宿主泛琥珀酰化抑制剂,在Caco-2和HEK293T-hACE2两种细胞系中评估其抗病毒效率。最终发现VPA, ST1326, 格列苯脲 (Glyburide), 以及氯屈膦酸二钠 (clodronic acid disodium salt) 在细胞水平具有显著抗病毒的效果。
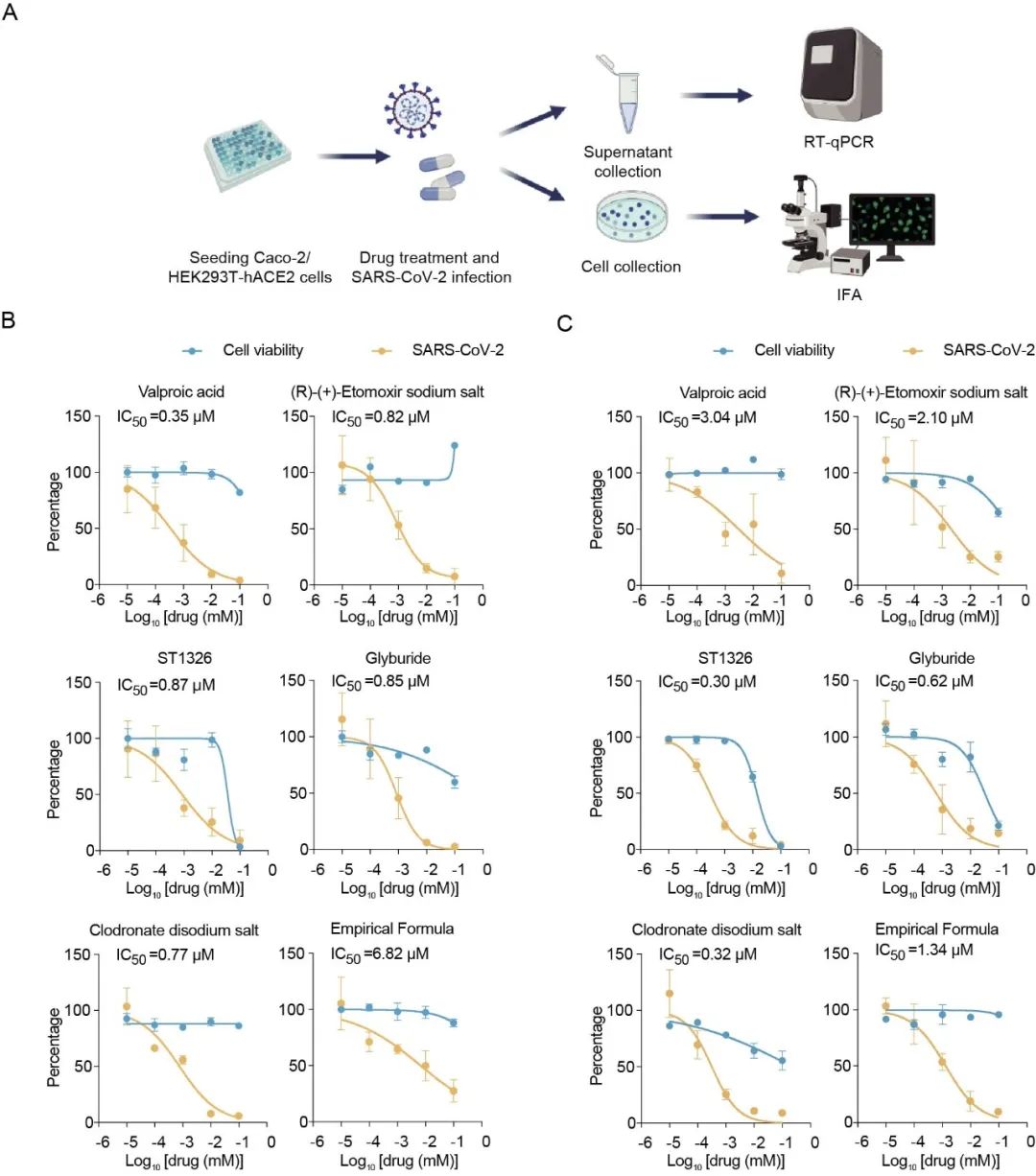
评估琥珀酰化抑制剂抗病毒效率
该研究主要负责人,朴衡科技联合创始人赵翊丞教授表示:我们通过对新冠病毒侵染细胞后的功能多组学分析,从多个维度展示了病毒和宿主蛋白的琥珀酰化修饰水平变化,从而确定了SARS-CoV-2对宿主细胞蛋白泛琥珀酰化的调控机制,并发现了针对病毒引起的异常琥珀酰化靶点的潜在候选药物。本研究不但拓展了我们对新冠病毒感染宿主传播机制的研究奠定了基础,而且为新冠的治疗提供了新的方向。
参考文献
1. Z. Zhang, et al., 2011. Identification of lysine succinylation as a new post-translational modification. Nat Chem Biol.
2. Quan Liu, et al. 2022. The global succinylation of SARS-CoV-2–infected host cells reveals drug targets. PNAS.
