Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
News Center
Nature Communications:朴衡生信团队助力揭示蜱传森林脑炎病毒感染图谱
2024年11月30日,吉林大学研究团队在国际期刊《NatureCommunications》发表了题为《Multi-protomics analysis identified host cellular pathways perturbed by tick-borne encephalitis virus infection》的最新研究进展。朴衡生信团队为该项研究提供了深度个性化多组学分析服务,结合蛋白质组、磷酸化蛋白质组、乙酰化蛋白质组多组学,多维度地分析了细胞对 TBEV 感染的多个水平的反应。结果揭示了TBEV感染对先天免疫反应、核糖体生成、自噬与DNA损伤反应(DDR)产生了深刻影响。其中病毒的非结构蛋白NS5可阻碍DNA损伤反应,前体膜蛋白prM可诱导自噬(图1)。使用靶向DDR和自噬的抑制剂以及特异性激酶表现出强大的抗病毒作用。以上结果表明病毒感染导致的失调途径和激酶是抗病毒治疗的潜在靶点,这项基于多组学的TBEV综合分析对于研究病毒发病机理以及针对病毒的药物研发具有重大意义。
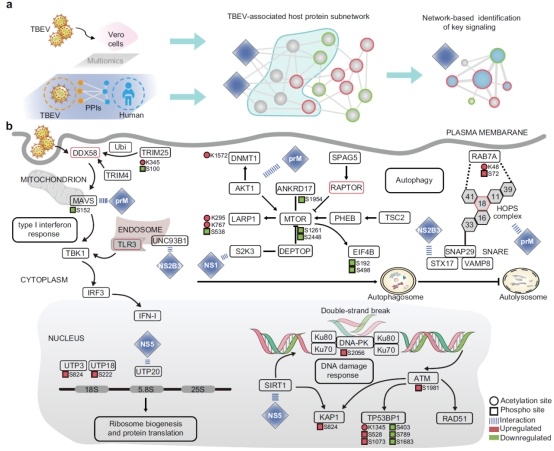
图1多组学分析揭示病毒感染干扰的分子信号通路
TBEV感染后的蛋白质组、磷酸化蛋白质组、乙酰化蛋白质组分析
研究人员收集了不同时间的被TBEV病毒感染的非洲绿猴肾细胞Vero细胞,对多时间点进行蛋白质组、磷酸化蛋白质组、乙酰化蛋白质组质谱分析(图2)。病毒感染后干扰素刺激基因蛋白表达显著增加,影响了多个效应蛋白的磷酸化水平,涉及细胞骨架和DNA损伤反应(DNA damage response, DDR)此同时病毒感染后还诱导了线粒体代谢、RNA剪切加工蛋白的乙酰化水平显著增高,TBEV感染导致组蛋白乙酰化明显减少,这表明TBEV还可能通过影响组蛋白乙酰化来影响宿主细胞的转录活性。经过分析研究人员还发现了一些蛋白同时存在磷酸化和乙酰化修饰的变化(图2)。
研究人员同样对病毒蛋白的翻译后修饰进行了分析。四个病毒蛋白prM、NS2B、NS3和NS5均发生了磷酸化,其中NS5的多个磷酸化位点在不同黄病毒中高度保守。七个病毒蛋白发生了乙酰化,其中E、NS3 和 NS5 是修饰程度较高的病毒蛋白,这些修饰位点对病毒蛋白的功能具有重要调控作用。
图2 TBEV感染后的蛋白质组、磷蛋白组和乙酰蛋白质组分析
多功能蛋白质组学分析揭示TBEV感染后引发的关键通路
研究人员进一步分析了TBEV感染后蛋白和蛋白修饰水平均发生显著变化的信号通路,例如核糖体生成、DNA损伤反应以及和病毒感染紧密联系的经典信号通路。分析结果暗示NS5可能影响了DDR以及核糖体生成,NSB3和PrM参与固有免疫反应和自噬调控。
NS5通过SIRT1感染宿主的DNA损伤反应
为了验证多组学分析中提出的TBEV感染对宿主DDR的调控,研究人员首先验证了TBEV感染后诱导DNA损伤,从蛋白质和蛋白质修饰的角度分析了DNA损伤反应涉及的基因表达。组学数据显示进行DNA同源修复的核心蛋白Ku70/80和DNA-PK蛋白的乙酰化修饰水平在病毒感染后显著升高,考虑到SIRT1对Ku70的乙酰化作用,研究人员猜想是否因为病毒蛋白可与SIRT1互作抑制其对蛋白的去乙酰化作用,从而抑制同源修复效率。后续实验也验证了TBEV病毒的NS5蛋白可与SIRT1相互作用,过表达SIRT5可以显著降低Ku70和KSP1的乙酰化修饰水平同时抑制病毒复制,相反病毒感染以及过表达NS5可以显著提高蛋白乙酰化修饰水平(图3)。
图3. NS5通过与SIRT1相互作用干扰宿主DDR
PrM诱导自噬但抑制自噬溶酶体形成
TBEV感染后宿主细胞内的自噬体相关蛋白及自噬体累积明显,联系蛋白质多功能组学分析结果以及参与自噬的调控途径,研究人员猜想病毒蛋白prM可能通过与AKT1 相互作用抑制AKT1-mTOR 信号通路诱导自噬。随后通过实验手段研究人员验证了prM与与AKT1的相互作用。过表达病毒PrM蛋白可抑制AKT1以及mTOR磷酸化,并且显著提高细胞自噬水平。相反过表达AKT1可显著抑制病毒复制。随后进一步通过实验验证了prM和NS2B3分别与VPS11和STX17相互作用调节自噬溶酶体的形成(图4)。
图4. PrM诱导自噬但抑制自噬溶酶体形成
使用脑类器官验证TBEV感染对宿主DDR与自噬的调控
上述基于人细胞系以及动物模型的实验在一定程度上验证了研究人员的猜想,但考虑到TBEV病毒引起的神经系统疾病以及2D培养条件的限制,研究人员决定使用人神经元细胞和脑类器官验证病毒感染引发的宿主反应。TBEV病毒感染T98G人脑胶质瘤细胞系后引起明显的DNA损伤以及自噬体的累积。接下来研究人员利用iPSCs诱导出人脑类器官,TBEV感染类器官后引起γH2AX的累积以及53BP1的减少、自噬体的增加。这些结果在人源化3D模型上验证了病毒感染对DNA损伤修复和自噬的调控(图5)。
图5.在神经元细胞和脑类器官中TBEV感染对DDR和自噬的调控
基于药理学的宿主调控可抑制病毒复制
根据上述的分析与实验结论,研究人员测试了37种药物和化合物对TBEV病毒复制的影响,实验结果显示部分激酶抑制剂、乙酰酶抑制剂、ATM和ATR抑制剂、SIRT1激活剂以及自噬抑制剂对TBEV复制有显著抑制作用(图6)。
图6.基于药理学的宿主调控可抑制病毒复制
本研究通过多组学分析揭示了TBEV感染对宿主细胞的多方面影响,为深入理解TBEV的致病机制提供了重要科学依据,并为TBEV及其他蜱传黄病毒的抗病毒药物开发提供了潜在靶点。
原文链接:https://www.nature.com/articles/s41467-024-54628-w
朴衡博迈聚焦于新型体外3D培养技术(NAC-organ技术),攻坚复杂疾病、免疫微环境等体外建模难题,开发了肝脏、复杂慢性疾病、肿瘤微环境等多种体外3D模型,打造了药物安全性检测、慢性疾病药效检测、抗肿瘤药效检测、递送系统效率检测等多个高通量检测平台。为客户提供模型开发、靶点筛选与验证、药物安全性评估、药效评价、递送系统优化等服务。NAC-Organ技术平台已服务于多家临床机构、科研院所及药物研发企业,公司致力于为新药研发、医学研究提供更精准、高效、经济的解决方案。
朴衡博迈(上海)生物医药有限公司为客户提供深度个性化多组学生信分析服务,包括对生物数据的搜索(收集和筛选)、处理(编辑、整理、管理和显示)及利用(计算、模拟)。从基因组学、转录组学、蛋白质组学到代谢组学,通过整合和分析大规模生物数据,解释生物过程的分子机制,加速疾病诊断、治疗和药物开发的进程。
- Previous article:前沿技术在基础医学与临床转化研究中的应用研讨会成功举办!
- next:文献分享 | 工程化人骨关节炎软骨类器官
