Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
新闻动态
文献分享 | 利用人诱导多能干细胞构建同时含胆管和血管的肝类器官
人诱导多能干细胞(hiPSCs)技术已成功用于开发由胆管细胞组成的囊性结构,模拟肝内胆管(IHBD)。考虑到血管与胆管相互作用对肝内胆管发育的重要性,开发一种围绕血管重建人类胆管的体外方法对理解人类新生儿胆管结构异常形成的机制至关重要。 日本东京大学理化学研究所的Hideki Taniguchi教授团队近期在《Nature Communications 》发表了题为《Generation of human iPSC-derived 3D bile duct within liver organoid by incorporating human iPSC-derived blood vessel》的论文。本研究通过模拟胎儿肝脏发育过程中门静脉(PV)与胆管(BD)之间的组织相互作用,成功在hiPSC肝类器官中生成胆管结构。该研究首次建立了一种培养方案,通过整合大型人工血管(BV),在肝类器官中生成胆管结构。
内容1:未成熟的平滑肌细胞(imSMC)可能与胆管祖细胞的早期分化相关。
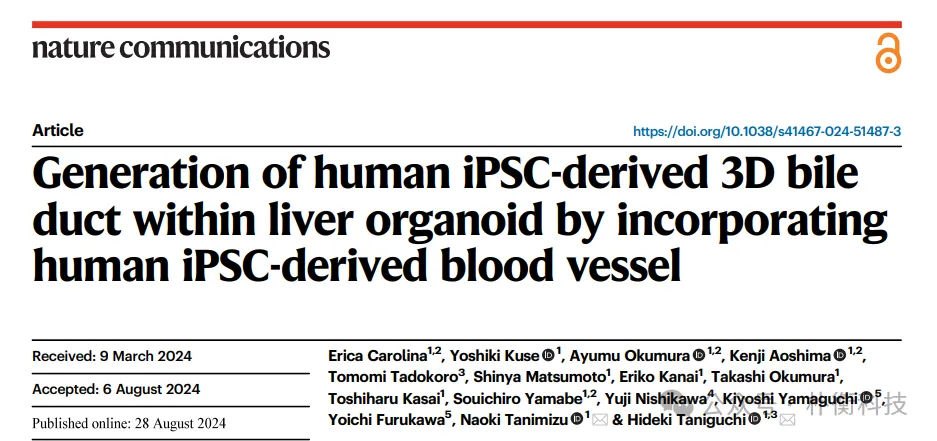
胆管细胞由双潜能肝脏祖细胞分化而来,主要依赖特定的门静脉区(PV)血管。PV的平滑肌细胞(PV-SMCs)在胆管发育中起关键作用。根据先前研究,平滑肌蛋白22(SM22)和α-平滑肌肌动蛋白(αSMA)分别为血管SMC(PV-SMC)早期和晚期标记物。我们对E15.5小鼠肝脏进行免疫染色,发现PV-SMC高表达SM22,而αSMA的强表达主要集中在肝门区,说明外周组织中的胆管细胞可能来源于新近分化的肝母细胞。进一步,对15周的人类胎儿肝脏切片的免疫染色结果表明,高表达SM22的PV-SMC(又称之为未成熟SMC,imSMC)与管腔形成相关。通过分析GW9-12胎儿肝脏单细胞转录组数据,确认Vimentin等基因的表达特征,揭示了血管SMC的相关性。基于这些结果,我们推测imSMC与胆管细胞的来源有关。
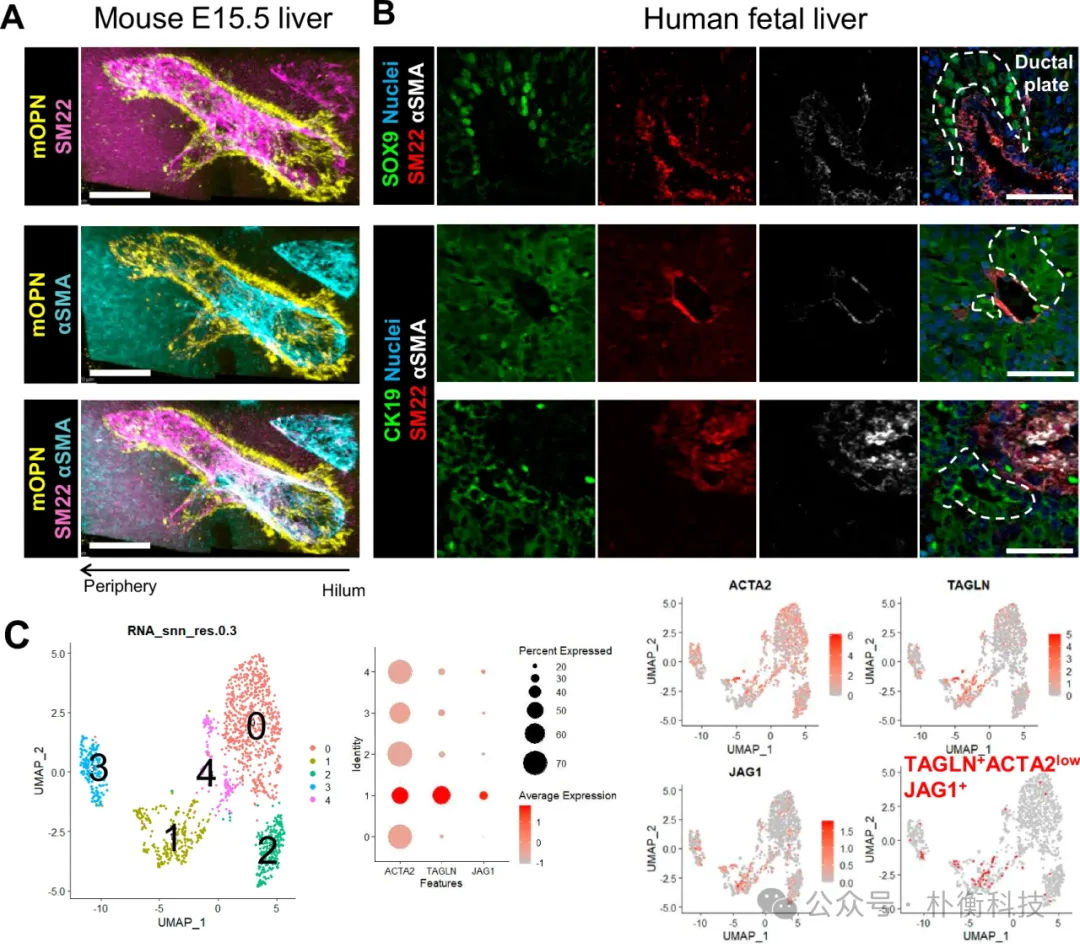
图1:免疫荧光和单细胞测序分析小鼠和人肝脏发育早期,imSMC和SMC的分布
内容2:利用iPSC细胞诱导生成平滑肌细胞
通过优化之前报道的hiPSC诱导血管SMC的分化方案,作者发现hiPSC-SMC的不同成熟阶段可能影响其促使双潜能肝祖细胞向胆管细胞分化的能力。在hiPSC-SMC分化过程中,免疫荧光和qPCR结果显示,imMSC在分化第6天出现,而成熟的SMC细胞在分化第10天出现。因此,通过新的培养方法,可以独立的诱导出imMSC和成熟的SMC细胞。
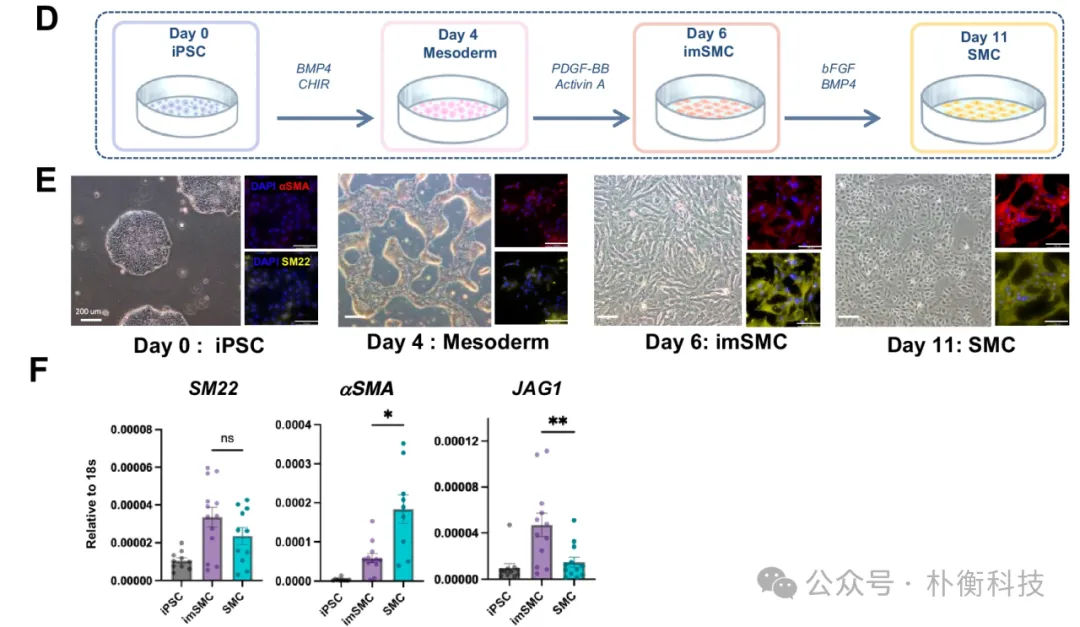
图2:imSMC和SMC诱导过程及鉴定结果
内容3:构建胆管、血管及肝类器官的3D共培养系统
为了构建含胆管的3D共培养系统(hiPSC-BV),作者使用了肝脏类器官、imSMC细胞和内皮细胞(EC),封装在I型胶原的支架。具体构建步骤为:用Parafilm®封住将剪开注射器的小孔;将imSMC或成熟SMC细胞,与含有TGFβ1和JAG1的DMEM培养基 、和I型胶原混合,最后转移至注射器中,使其凝固并去除多余水分。随后,将内皮细胞注入到构建的血管组织中,同时将肝母细胞、内皮细胞和间质细胞构建的肝类器官包裹在血管外侧,建立3D共培养系统。
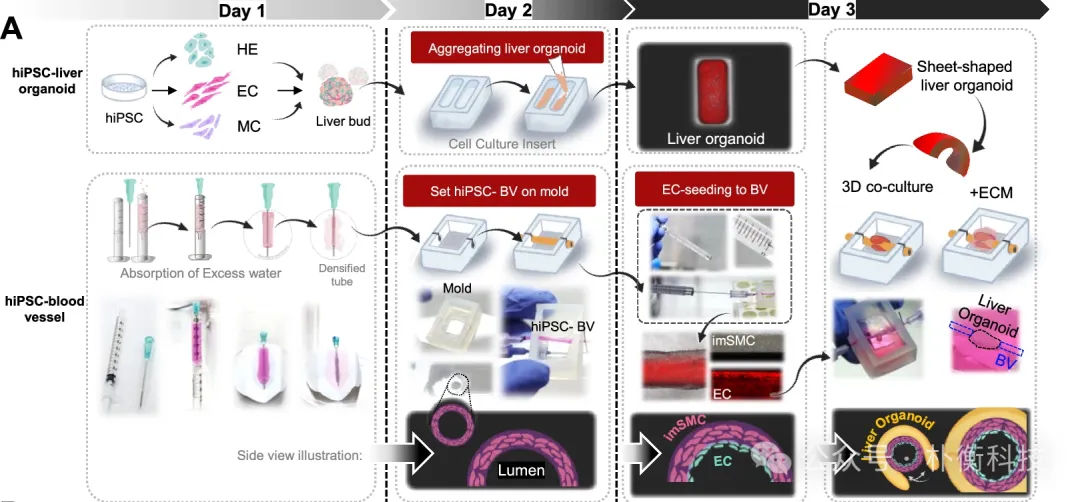
图3:3D共培养系统构建流程
根据先前研究,肝脏祖细胞中TGFβ和Notch信号的激活对胆管细胞分化至关重要。作者通过添加JAG1、TGFβ1和Lam511蛋白,观察到在共培养条件下形成了有网状结构的肝类器官(BVLO),且免疫染色显示形成胆管样管腔(CK19+阳性)。值得注意的是,当使用成熟的SMC构建BVLO时,并未形成BD结构。H&E染色和定量分析表明,BVLO内明显存在BD管腔。
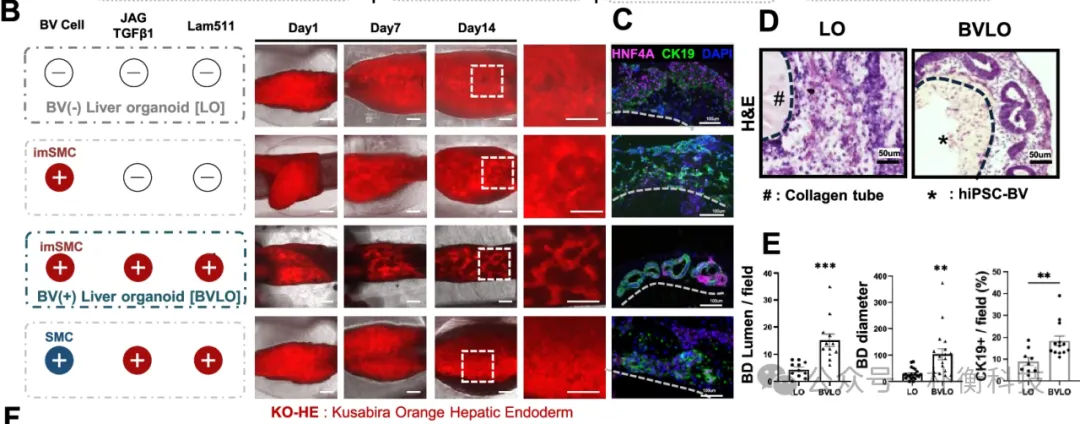
图4:3D共培养系统诱导生成胆管结构
内容4:hiPSC胆管建立上皮结构并具有分泌功能
为了进一步评估BVLO的结构和功能特征,作者对胆管结构进行了免疫荧光分析,结果显示CK19+CK7+阳性细胞环绕着延伸的管腔,表明hiPSC胆管细胞形成了胆小管。透射电子显微镜成像揭示了微绒毛的存在,并观察到细胞间隙的紧密连接结构。这些结果表明,hiPSC-肝脏祖细胞在BVLO中建立了胆管细胞的上皮特征。 为了评估BVLO的功能,研究者观察到MDR1能够将罗丹明123(Rho123)外流至管腔。此外,通过福斯可林诱导的肿胀试验评估胆管细胞的分泌功能,结果显示在福斯可林处理后,管腔直径明显增加,表明BVLO中的胆管细胞展现出功能性上皮特征。因此,作者构建的BVLO不仅具有胆管细胞特征,还具备分泌能力。
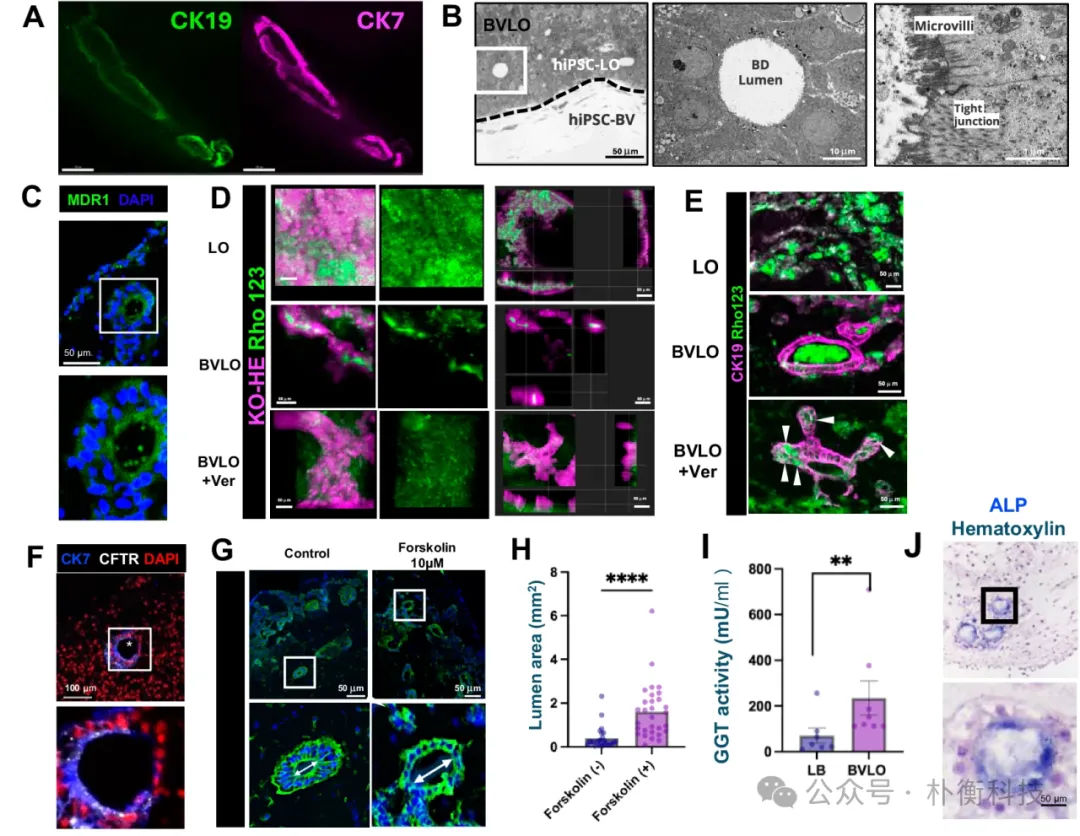
图5:hiPSC 胆管建立上皮结构并具有分泌功能
内容5:肝表面移植促进BVLO胆管细胞的成熟
为研究胆管细胞是否会在体内进一步分化,研究团队将BVLO移植到免疫缺陷小鼠的肝脏表面,观察到移植后顶端表面出现胆管标志物的表达,提示胆管细胞在体内培养后提前成熟。免疫荧光染色显示碳墨积聚在BVLO的胆管管腔内,证明BVLO在体内进一步成熟,移植的BD与宿主的肝内胆管相连。
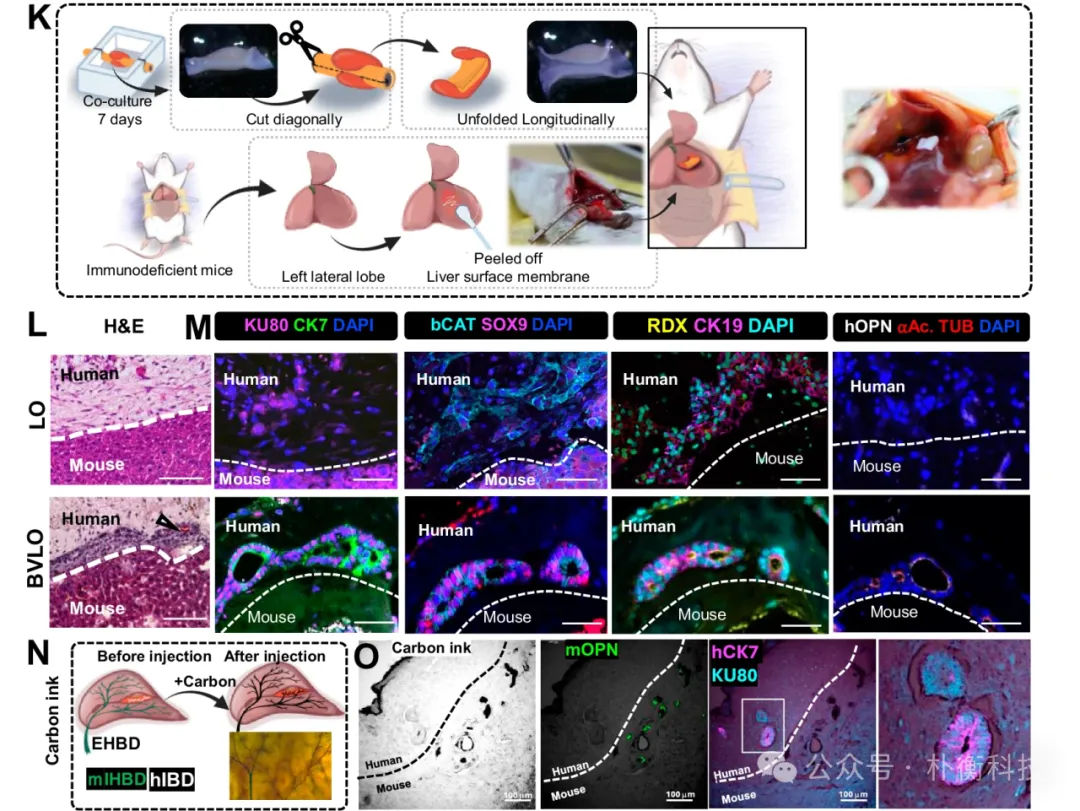
图6:肝表面移植促进BVLO中胆管细胞的成熟
内容6:BVLO移植可暂时改善胆汁淤积症的症状少
前面的结果表明,宿主与BVLO之间能建立胆汁淤积联系,因此作者推断BVLO移植可以改善胆汁淤积症状。在胆管结扎后,BVLO移植显著延长了小鼠的平均存活期,并减少了直接胆红素和总胆红素的升高。移植后第三天检测显示,移植胆管的管腔变大,推测BVLO的外部胆道结构 可能成为受体肝脏的辅助胆汁库,从而帮助缓解胆汁淤积症状。
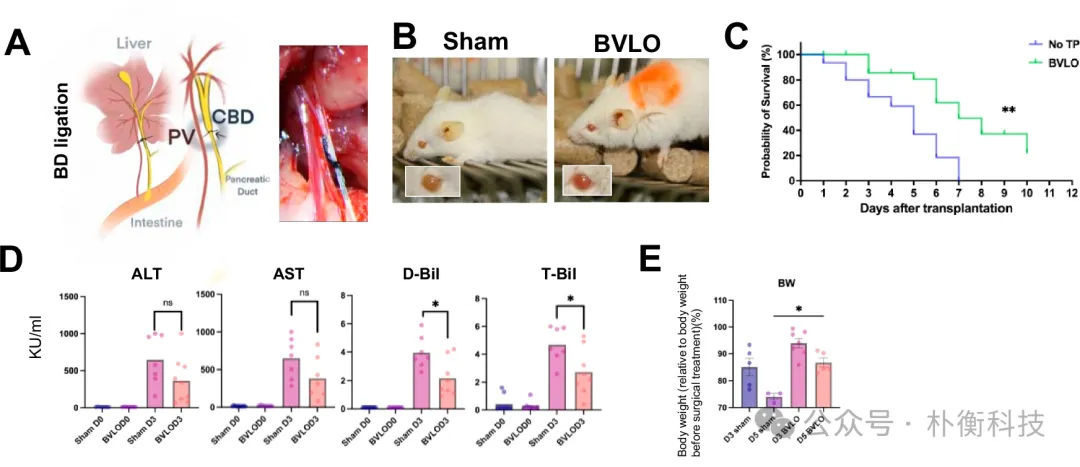
图7:BVLO肝表面移植后,胆管结扎小鼠模型的存活率得到暂时改善
总结 conclusion
本研究通过人工BV共培养上皮器官组织的方法,成功在体外衍生出复杂的肝脏结构,为模拟人类胆道疾病提供了重要工具。BV在促进血液循环、为组织/器官细胞输送营养和氧气方面的关键作用,强调了将BV整合到器官组织中的必要性。最后,研究还揭示了BV与上皮细胞相互作用的重要性,这对促进三维生理功能的上皮细胞器官组织结构的发展具有深远意义。
- Previous article:朴衡最新成果:利用NAC-Organ 3D 培养技术平台加速CAR-Macrophage细胞的高通量体外筛选
- next:创新突破 | 肝胆肿瘤类器官的多组学特征及个性化药物治疗前景
