上海市浦东新区蔡伦路780号8层810室
新闻动态
成果解读 | 新型核酸纳米载体实现对耐甲氧西林金黄色葡萄球菌的靶向及治疗
反义寡核苷酸(ASOs)虽可靶向mecA抑制 PBP2a表达,恢复 MRSA对β-内酰胺类抗生素的敏感性,但ASOs存在细胞摄取效率低、生物环境中易降解的缺陷。传统脂质或聚合物递送载体又面临生物相容性差、毒性高、稳定性不足等问题,难以实现临床转化。因此,迫切需要开发能有效抑制MRSA的新型药物。框架核酸(FNAs)尤其是四面体 DNA 纳米结构(tFNAs),凭借结构稳定、生物相容性好、可多药共载的独特优势,可为突破上述瓶颈提供新策略。

近日,朴衡博迈联合创始人赵翊丞特聘研究员团队与复旦大学附属中山医院朱长锋教授团队在Aggregate(IF=13.9)上发表最新研究 “Multifunctional Framework Nucleic Acid Vehicle for Antibiotic Sensitization and Treatment of Methicillin-Resistant Staphylococcus aureus”。该研究设计了共载mecA靶向 ASOs 与头孢曲松钠的新型四面体 DNA 纳米复合物(TACs),兼具高效药物递送、抗生素增敏与抗生物膜功能,可显著提升 MRSA 感染治疗效果。下面我们将为您带来该研究成果的详细解读。
一、TACs 的设计、合成及表征
团队设计的 TACs 由 tFNAs、靶向 mecA 基因的 ASOs 与头孢曲松钠共组装形成,通过受控聚集实现药物稳定负载与缓释。凝胶电泳证实核酸材料组装成功,紫外吸收光谱表明头孢曲松钠成功负载,原子力显微镜观察到其呈均匀四面体结构。性能上,药物负载效率在头孢曲松钠浓度达 500 μg/mL 后稳定,体外释放实验中 48 小时累积释放率 69.3%,显著优于游离头孢曲松钠;动态光散射检测显示其粒径 33.31±1.10 nm、zeta 电位14.37±0.71 mV,结构稳定(图1)。
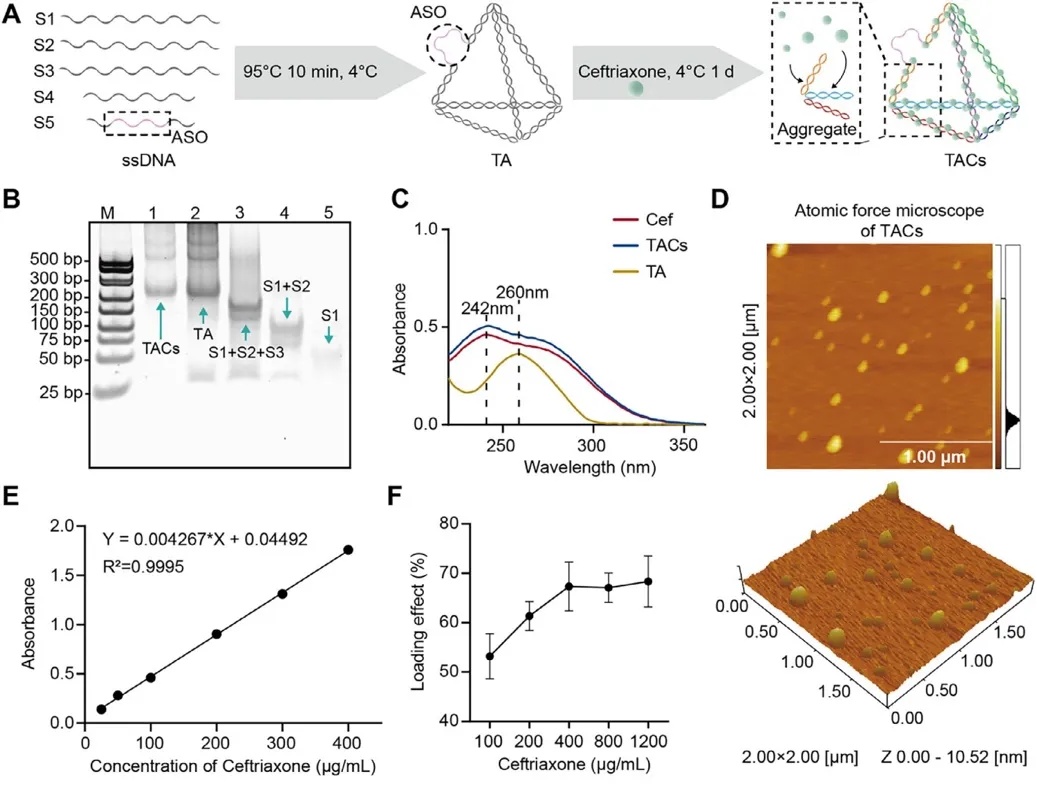
图1 TACs 的设计、合成和表征
二、TACs 的体外抗菌活性
体外实验表明,TACs 通过耐药逆转与杀菌的协同作用,显著增强对 MRSA 的抑制与杀灭效果。抗菌活性上,其对 MRSA USA300 的最低抑菌浓度仅 16 μg/mL,较游离头孢曲松钠降低 16 倍。0.5×MIC 时抑制作用强于其他组,0.25×MIC 仍具杀菌活性,4×MIC 即可实现≥99.9% 细菌杀灭,而游离头孢曲松钠需16×MIC(图2)。
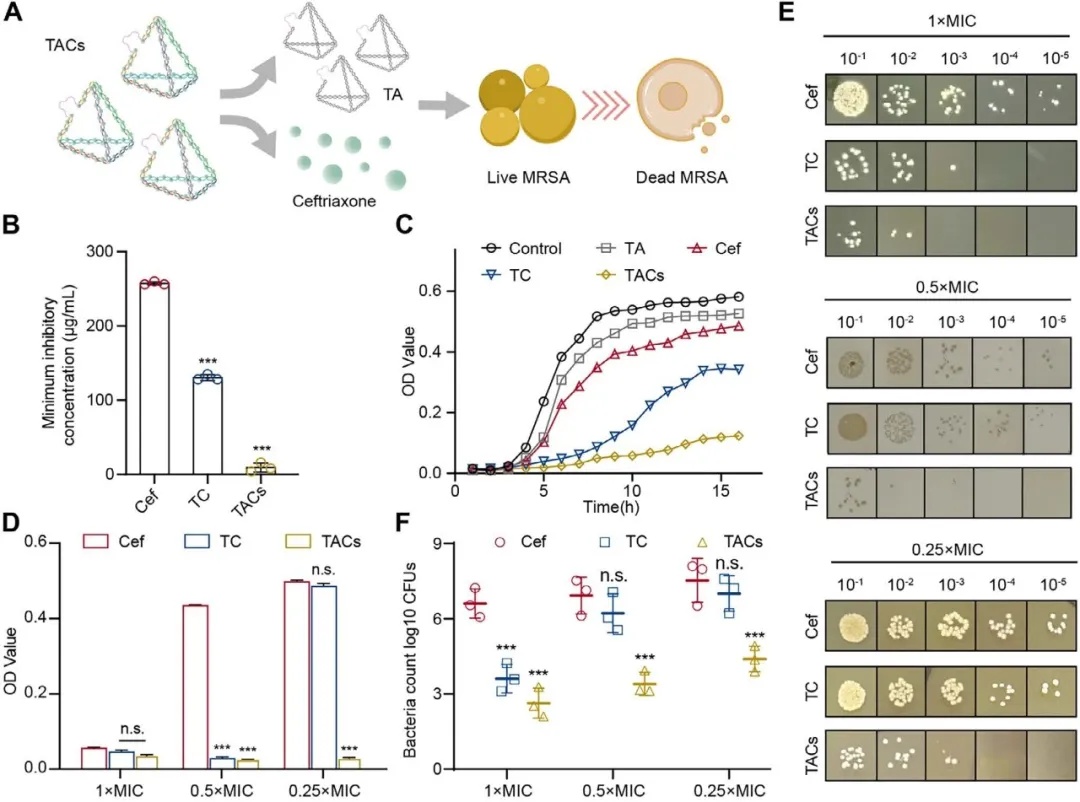
图2 TACs 对 MRSA 的体外抗菌活性
三、TACs 降低 MRSA 耐药性的作用机制
作用机制方面,TACs 可被 MRSA 高效摄取,以浓度依赖性抑制 mecA 基因转录与 PBP2a 蛋白表达。其中TACs携带的的ASOs 靶向结合 mecA mRNA 抑制 PBP2a 合成、恢复细菌药敏性,Cef 抑制细胞壁肽聚糖交联,二者协同杀菌(图3)。
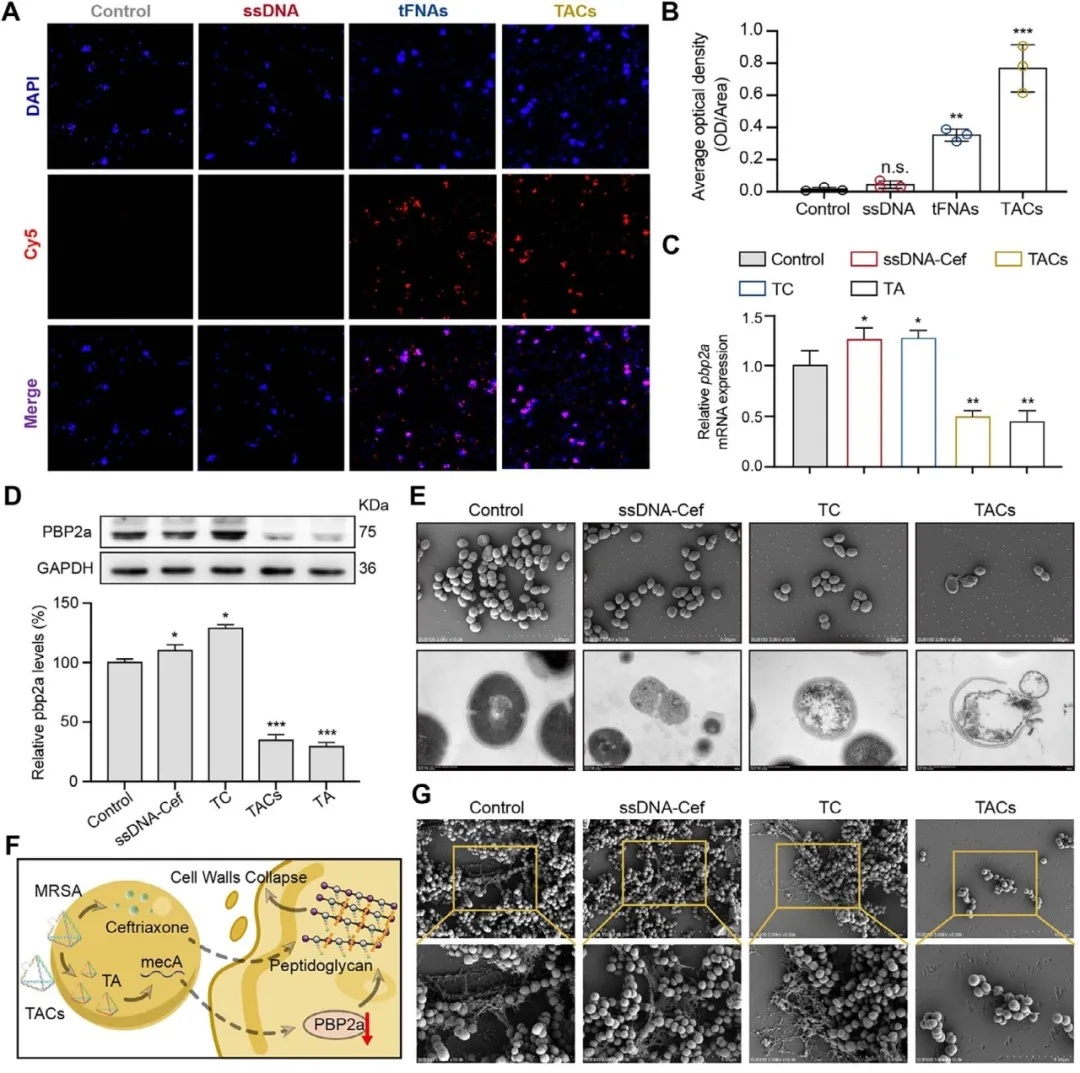
图3 TACs 降低 MRSA 耐药性的作用机制
四、TACs 的安全性评估
动物水平验证表明,TACs 生物相容性优异,无显著毒副作用。C57BL/6J 小鼠尾静脉注射 750 nM TACs 后,肝肾功能指标与血常规参数均在正常范围,心脏、肝脏、脾脏、肺、肾脏的 H&E 染色切片显示组织结构完整,无炎症浸润或组织损伤(图4)。
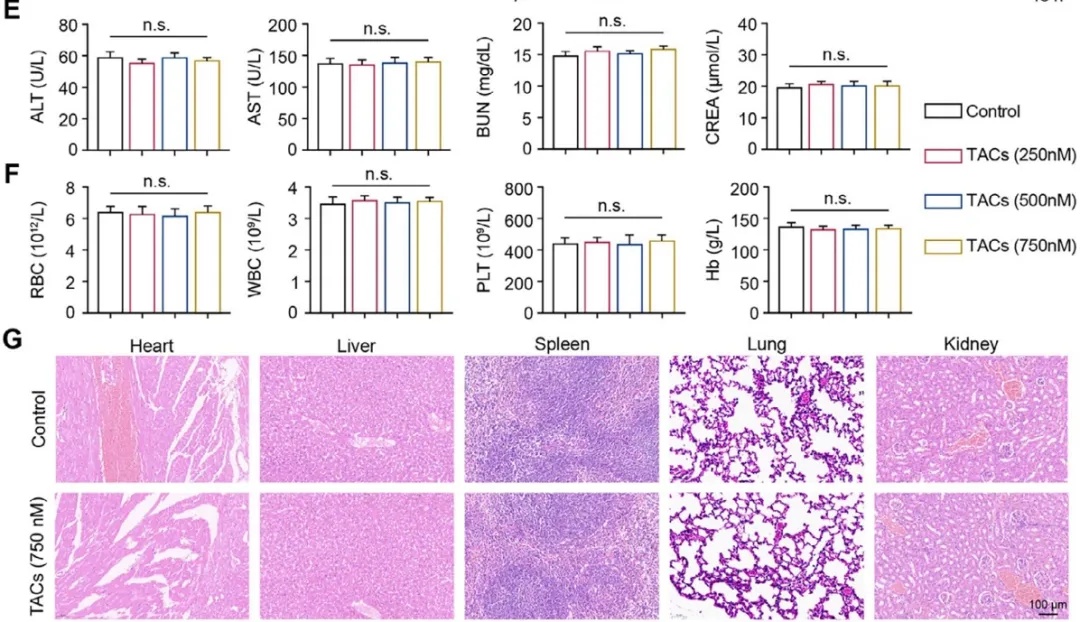
图 4. TACs 的安全性评估
五、TACs 的体内治疗效果
在模式生物感染模型中,TACs展现卓越治疗效果,显著改善感染预后。使用小鼠肺炎模型,经鼻滴注致死剂量 MRSA 后,TACs 处理组小鼠 72 小时存活率达 80%,显著优于对照组与游离头孢曲松钠组,亚致死剂量感染下,TACs 处理使小鼠肺组织细菌负载大幅下降,病理分析显示其能显著减轻肺组织充血与炎症细胞浸润、恢复肺组织弹性(图5)。
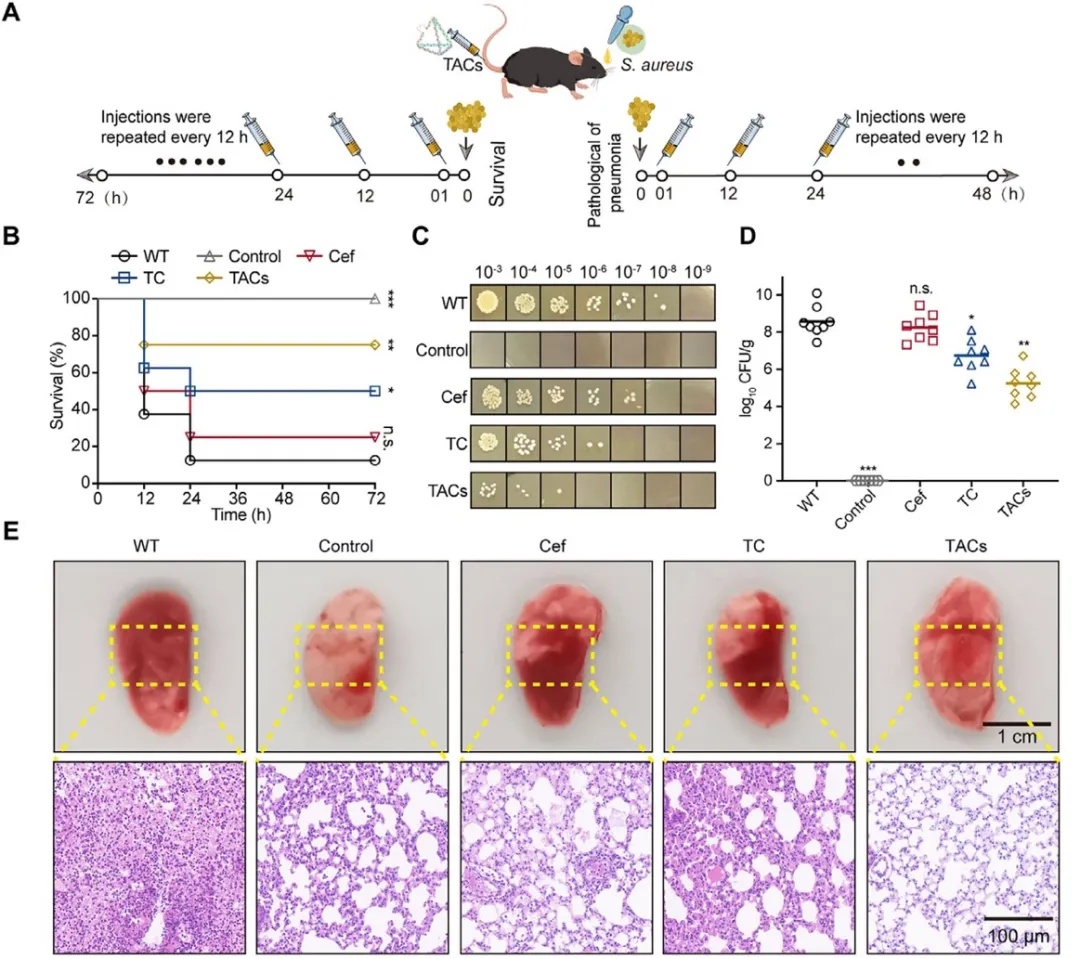
图5 TACs 对 MRSA 诱导小鼠肺炎的治疗效果
总结与展望
TACs系统的成功研发为耐药菌治疗提供了新方向,其核心优势在于多靶点协同作用(同时针对耐药基因和细菌生存途径)、智能纳米递送系统(精准富集药物以减少副作用)以及广谱应用潜力(适配多种抗生素和靶基因)。该技术的突破性不仅在于新型抗菌剂的开发,更展示了基因沉默联合药物增效的协同治疗策略,为全球抗耐药斗争提供了创新思路。
朴衡科技在纳米核酸材料技术方面具有丰富的开发经验和一系列的国际领先成果,具有多项专利技术。凭借成熟的设计经验和高效的合成技术,聚焦于可编程合成人工核酸分子系统的设计构建及其在生物检测与治疗领域的应用研究。可为客户提供定制化的核酸纳米材料的设计、合成、检测、验证等一系列服务,帮助客户设计、开发用于生物检测、药物递送、基因治疗等用途的各种核酸纳米材料。目前参与合作多个核酸纳米材料研究项目已在Advanced Science、Aggregate等顶级期刊发表。
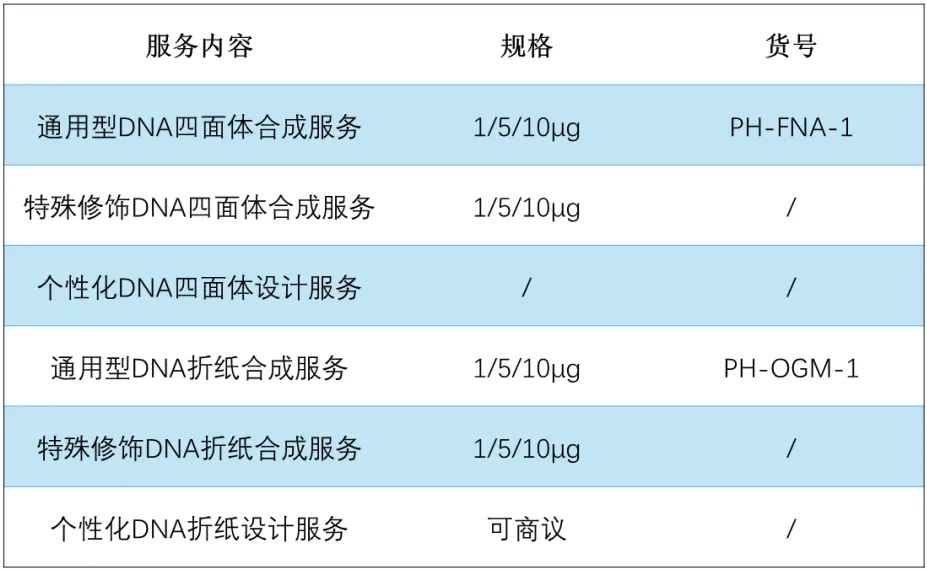
备注:核酸材料合成服务包含鉴定报告
