上海市浦东新区蔡伦路780号8层810室
新闻动态
成果解读 | 朴衡人源化MASH模型助力解析MASH 相关肝癌发生新机制
代谢功能障碍相关脂肪性肝病(MASLD,原非酒精性脂肪肝 NAFLD)全球发病率已达 20%-25%,其严重亚型代谢功能障碍相关脂肪性肝炎(MASH)是肝细胞癌(HCC)的重要诱因,目前约占全球肝癌病例的2%,预计2030年将成为肝癌的首要病因。
与HBV/HCV相关肝癌相比,MASH 相关肝癌具有独特的分子和免疫特征,脂质过载会引发氧化应激、复制应激及核苷酸库失衡,进而导致DNA损伤和突变积累,成为关键癌前事件。目前的研究模型主要基于动物模型,传统类器官细胞类型单一并非理想的研究工具。朴衡博迈自主研发的NAC-organ技术构建可快速构建保留患者肝实质细胞、肝窦内皮细胞、肝星状细胞、库普弗细胞的3D MASH模型(NN-HS-01),既保留临床样本的组织特异性和病理相关性,又具备稳定造模以及可操控性的优势,解决了2D细胞系不贴近体内、动物模型周期长且难以精准调控单一变量的难题。

Cancer Communications,16 October 2025
DOI:10.1002/cac2.70061
朴衡博迈自主研发的MASH 3D模型作为该研究中的核心实验模型,在体外复现出体内肿瘤细胞面临的脂质应激环境,明确了circTACC3的核定位、表达特异性及其对MASH相关肝细胞癌恶性表型的调控作用,后续研究人员在类器官模型上验证了m⁶A修饰对circTACC3功能的潜在治疗干预效果。3D MASH类器官为深入解析MASH相关疾病的分子功能机制提供了理想的体外实验平台。
二、利用3D MASH类器官明确m⁶A 修饰对 circTACC3 功能的调控及潜在治疗效果
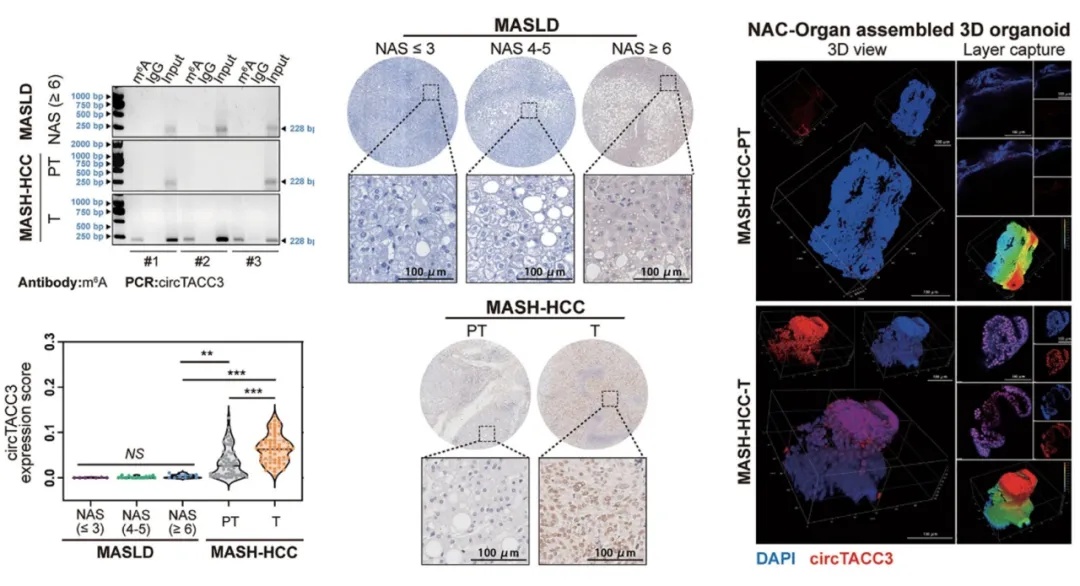
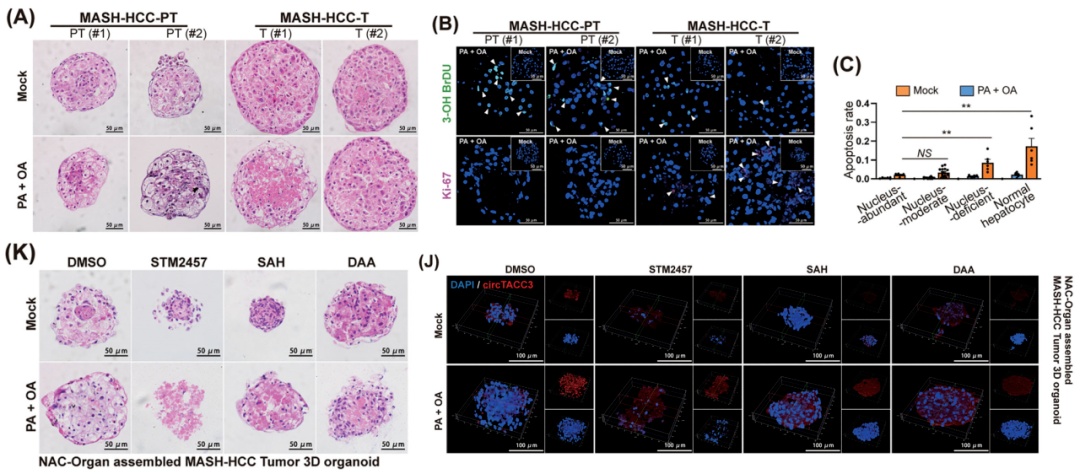
研究团队使用了NAC-Organ技术构建了MASH相关肝细胞癌组织及相应癌旁正常组织来源的3D MASH模型。结果显示在脂质过载诱导下,核内circTACC3 表达与类器官的增殖增强、脂质积累增加及凋亡减少密切相关。当使用m⁶A抑制剂(STM2457、SAH、DAA)处理MASH类器官时,不仅circTACC3的m⁶A修饰水平显著降低,其核内聚集现象也被抑制,同时类器官出现体积缩小、形态受损、脂质积累减少、增殖活性下降、凋亡率升高等表型。以上结果表明m⁶A修饰是circTACC3维持核定位及促肿瘤功能的关键,且通过抑制m⁶A修饰可逆转MASH相关肝细胞癌的恶性表型。在类器官模型中可实现连续药物处理,模拟体内长期给药的效果,相比2D细胞系的短期药物处理,更能反映药物对肿瘤细胞恶性表型的长期调控作用,为体内动物实验的药物剂量选择及干预策略提供了重要数据支撑(图2)。
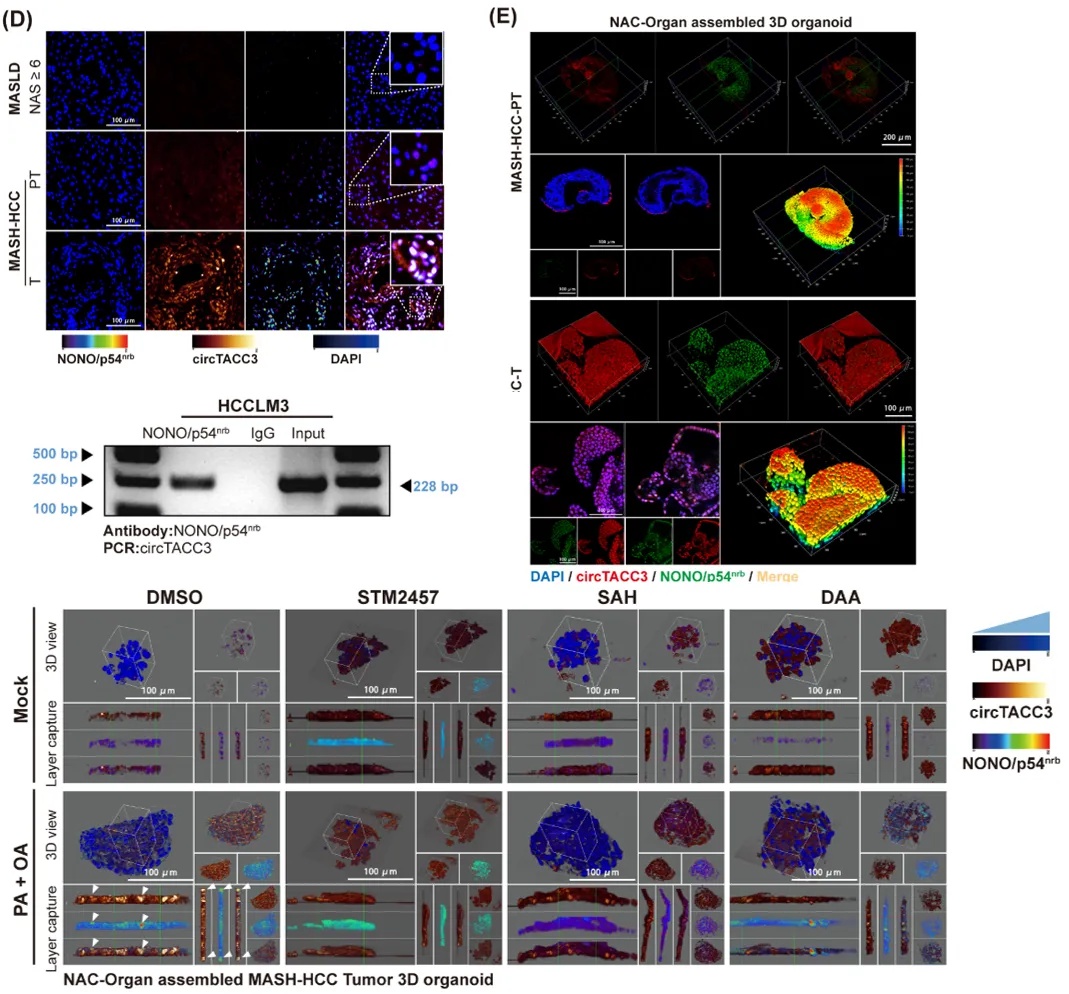
三、临床样本与类器官验证circTACC3 与 NONO/p54nrb的相互作用
研究人员使用了不同的肝癌细胞系,通过F2-circTACC3 pulldown、RIP、FLIM-FRET 等实验,证实了 circTACC3 可与 paraspeckle 核心蛋白 NONO/p54nrb直接结合,且在 PA+OA 诱导脂质过载下,二者核内共定位及聚集增强。随后为排除细胞系特异性干扰、验证上述相互作用的体内病理意义,研究团队在 MASH 相关HCC临床肿瘤组织和肿瘤组织来源的3D MASH模型中,通过免疫荧光与荧光原位杂交联合染色确认了circTACC3 与 NONO/p54nrb的共定位情况。上述结果表明,circTACC3 与 NONO/p54nrb的相互作用与共聚集并非体外细胞系的偶然现象,而是MASH相关 HCC 肿瘤组织的病理特异性特征,朴衡博迈构建的患者来源的3D MASH模型能精准还原该临床病理特征(图3)。
总结
本研究首次系统揭示了m⁶A 修饰介导的circTACC3–paraspeckle–R 环正反馈通路在MASH 相关肝癌中的核心作用。通过临床样本、肝癌细胞及3D MASH类器官模型的多层验证,研究表明circTACC3是该疾病的特异性分子标志物,其通过调控核内RNA–DNA杂交结构促进基因组重塑与肿瘤进展。类器官模型的引入使得研究更贴近真实代谢病理环境,为MASH相关肝癌的早期诊断与靶向干预提供了可行的新方向,也为探索代谢相关实体瘤的核内RNA调控机制奠定了重要基础。
朴衡博迈自主研发的3D MASH模型中包含肝实质细胞、肝窦内皮细胞、肝星状细胞与库普弗细胞,经MASH培养基诱导后呈现出符合MASH病理特征的典型表型:包括脂肪变性、气球样变、炎症反应以及纤维化。根据不同试用场景我们分为3D MASH一代模型(NAC-MASH MIX,NN-HS-01)与3D MASH二代模型(NAC-NASH Package,NN-HS-02)。其中一代模型直接将肝实质细胞、肝窦内皮细胞、肝星状细胞与库普弗细胞混合造模。二代模型首先构建肝实质细胞、肝窦内皮细胞与Kupffer细胞的核心,随后加入肝星状细胞构建外壳,能更好地模拟MASH进展过程中的外周纤维化状态(图1)。该3D MASH 模型可对多类药物处理产生多维响应,从抑制脂滴生成、炎症反应到纤维化进展等方面综合评估药效,亦是药物毒性测试、药物筛选、代谢干预与信号通路验证的理想平台(图2)。
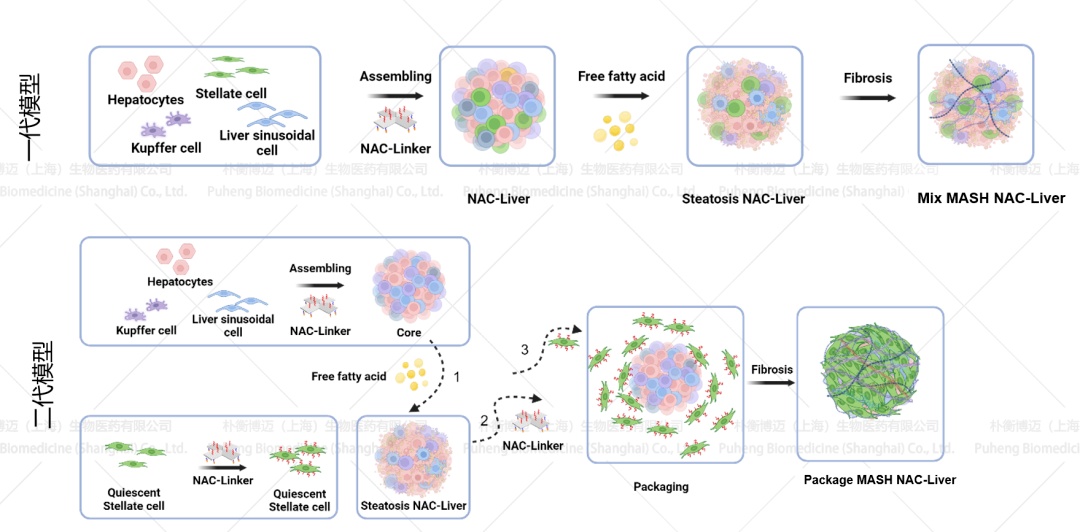
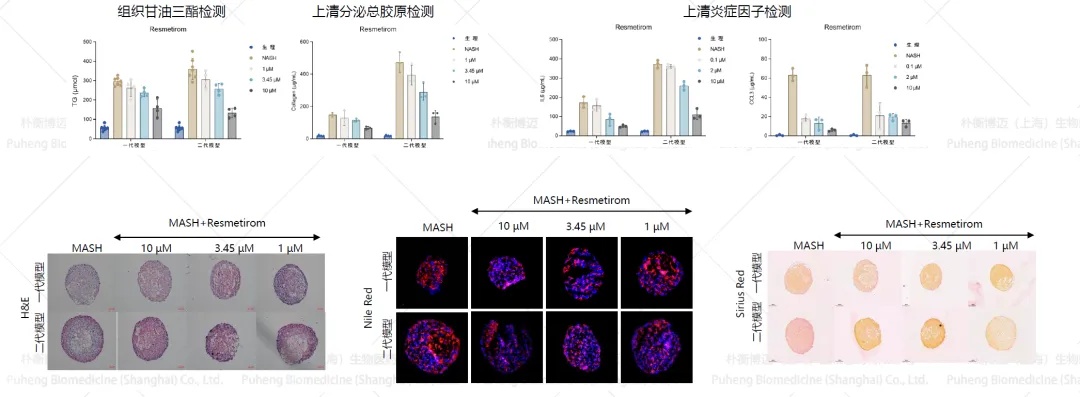
图2 NAC-Organ MASH模型药效评估结果
