类风湿性关节炎(Rheumatoid arthritis,RA)是一种发病机制不明的自身免疫性疾病,以多发对称性糜烂性关节炎为主要临床表现,体内存在多种自身抗体,滑膜明显增生和炎性细胞浸润,导致关节破坏,甚至关节外系统损害,严重影响患者的生活质量。目前,针对RA治疗的药物研发面临诸多挑战,现有的研究模型难以充分分析RA复杂的发病机制,并且不能满足高通量药物筛选的需求。来自北京大学深圳医院的王庆文教授带领团队在Materials Today Bio(IF=8.7)上发表了题为《Constructing a 3D co-culture in vitro synovial tissue model for rheumatoid arthritis research》的文章。文章构建了一种3D培养的滑膜类器官用于RA的研究,并评估了其作为药物筛选平台的潜力。

一、细菌纤维素(Bacterial Cellulose, BC)的制备与表征
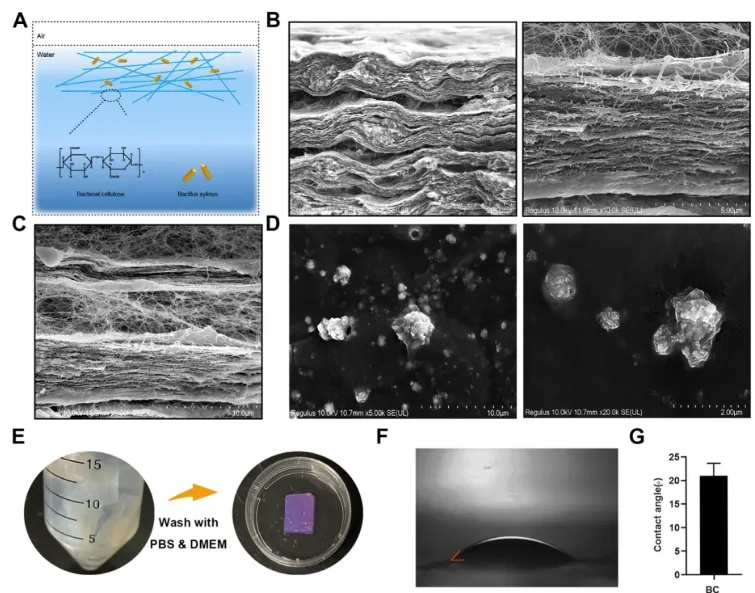
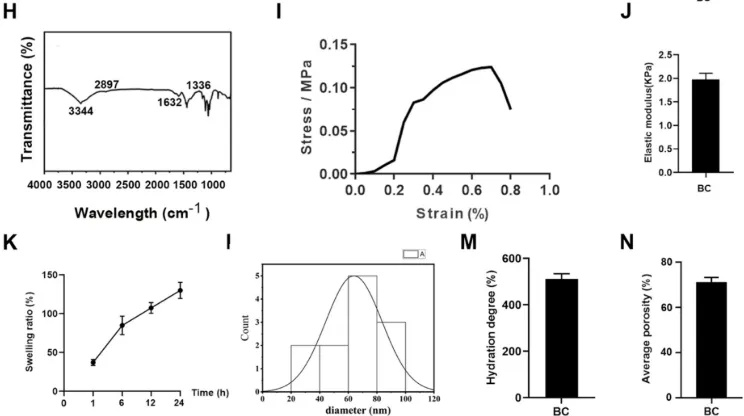
图1 细菌纤维素的表征
(A)细菌纤维素示意图。(B, C)细菌纤维素的侧面扫描电子显微镜(SEM)和微观结构。(D)BC上滑膜类器官的SEM图像。(E)细菌纤维素处理流程图。(F, G)细菌纤维素的水接触角和定量。(H)细菌纤维素的FTIR光谱。(I)应力-应变曲线。(J)弹性模量。(K)不同时间点细菌纤维素的溶胀率。(L)细菌纤维素中纳米纤维的直径分布。(M)细菌纤维素的水化程度。(N)细菌纤维素的平均孔隙率。
利用木芽孢杆菌制备BC,对其微观形态、应力应变、弹性模量、亲水性等多种性能进行全面表征。结果显示,BC具有精细的纳米网络结构、良好的亲水性和机械性能,能为细胞生长提供理想的微环境。
二、 基于BC的3D培育促进细胞间通讯
从RA患者关节置换手术中获取滑膜组织,制备原代类风湿性关节炎成纤维样滑膜细胞(RA-FLSs),同时诱导THP-1细胞分化为M1巨噬细胞,并对标志性marker进行鉴定,随后收集其在不同培养条件下(2D,3D)的上清培养基(CM)。用不同条件下培养的M1巨噬细胞的CM刺激RA-FLSs和HUVECs,发现3D培养条件下的CM能显著促进细胞的病理表型转化,RA-FLSs的增殖、迁移和侵袭能力增强,HUVECs的血管生成能力提升。
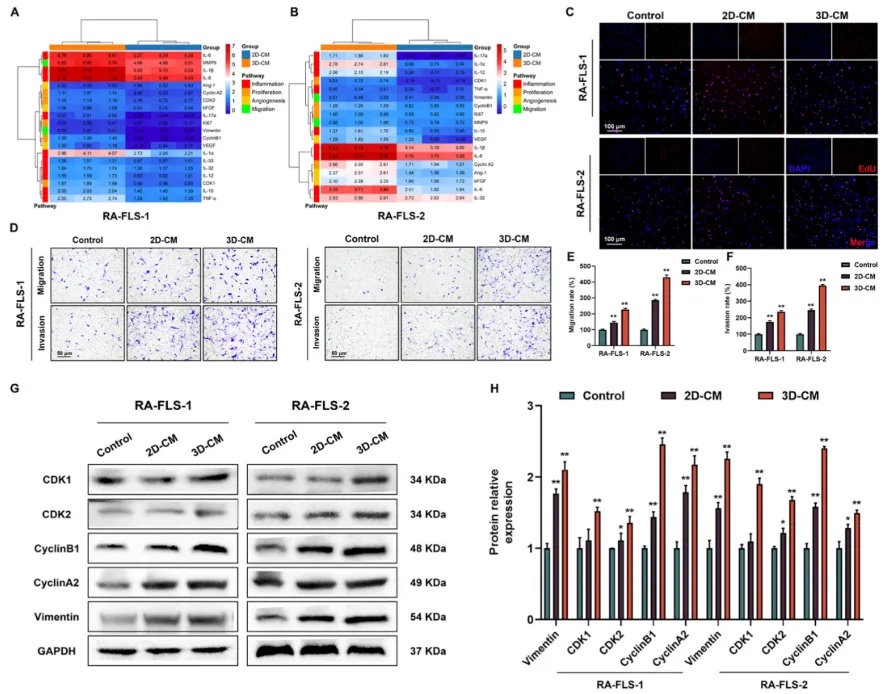
图2 3D共培养促进了
RA-FLS-1和RA-FLS-2病理表型的转变
(A, B)M1巨噬细胞经2D-CM和3D-CM处理24小时后基因的相对表达。(C)2D-CM和3D-CM处理24小时后RA-FLS的EdU检测。(D-F)Transwell assys显示,与对照组相比,2D-CM和3D-CM刺激48 h后,RA-FLS的迁移和侵袭能力增强。(G, H)用2D-CM和3D-CM处理RA-FLS后,通过蛋白质印迹分析细胞周期和迁移相关蛋白的相对表达水平。与对照组相比,*p < 0.05和 **p < 0.01。数据以平均值± SD表示。
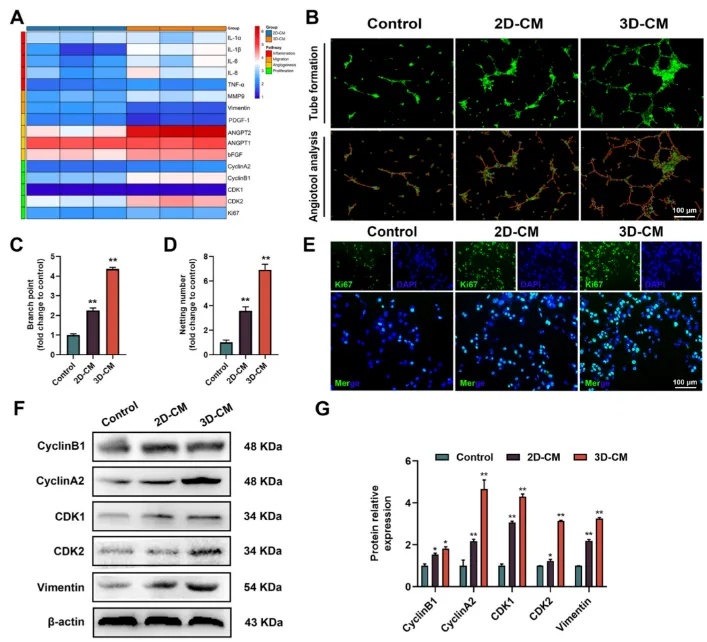
图3 3D共培养可促进HUVEC病理表型的转变
(A)2D-CM和3D-CM处理72小时后HUVEC的相对基因表达。(B)用2D-CM和3D-CM培养的HUVEC的管形成试验和AngioTool软件定量。(C, D)管形成实验的量化,包括分支点和网数目。(E)2D-CM和3D-CM作用24 h后,用Ki 67免疫荧光染色检测细胞增殖情况。(F, G)用2D-CM和3D-CM处理HUVEC后,通过Western blot分析细胞周期和迁移相关蛋白的相对表达水平。与对照组相比,*p < 0.05和 **p < 0.01。数据以平均值± SD表示。
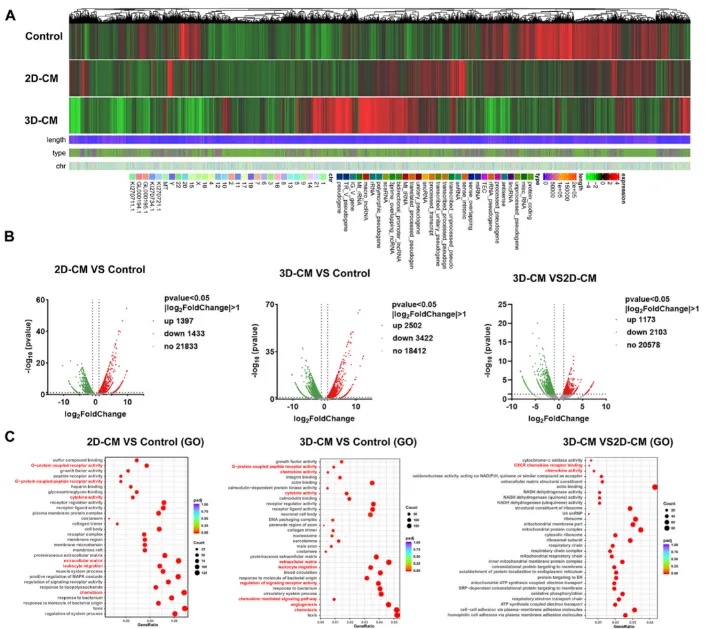
三、基于BC的3D培养促进细胞具有更多RA相关转录组特征
转录组特征分析:对RA-FLSs和HUVECs进行RNA测序,发现3D培养条件下的CM可以诱导两种细胞具有更多与RA相关的转录组特征,KEGG和GO富集分析揭示了相关的信号通路和生物学过程。
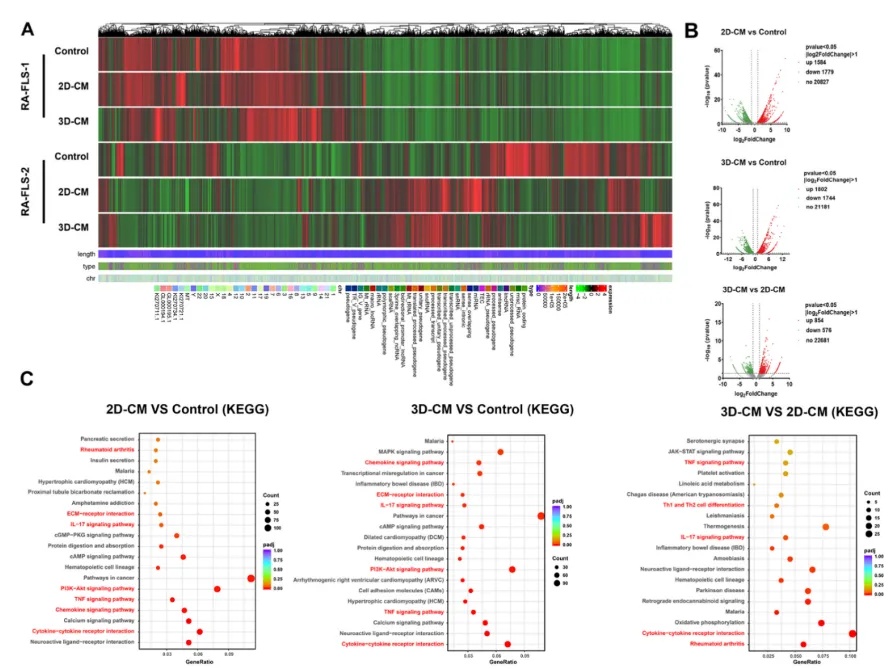
图4 3D滑膜组织中RA-FLS的转录组学表征
(A)聚类热图显示了2D-CM和3D-CM处理后RA-FLS的差异表达基因。(B, C)火山图表示与对照组相比,2D-CM和3D-CM处理后RA-FLS-2的差异表达基因。(D)京都Encyclopedia of Genes and Genomes(KEGG)富集分析显示不同信号通路富集,包括IL-17信号通路、TNF信号通路、PI 3 K/AKT信号通路、趋化因子信号通路、RA等。(E)基因本体(GO)富集分析显示生物学过程、分子功能和细胞组分中的差异基因富集,包括趋化因子活性、细胞因子活性、趋化性、白细胞迁移、血管生成等。
图5 3D滑膜组织中HUVECs的转录组学表征
(A)热图显示了2D-CM和3D-CM处理后HUVEC的差异表达基因。(B)火山图表示与对照组相比,2D-CM和3D-CM处理后HUVEC中基因的差异表达。(C)GO富集分析显示,基因在生物学过程、分子功能和细胞组分中富集不同,包括细胞因子活性、趋化性、白细胞迁移、血管生成等。(D)KEGG富集分析显示,基因在不同的信号通路中富集,PI 3 K/AKT信号通路、Notch信号通路、TGF-β信号通路、细胞周期、RA等。
四、FABP4促进细胞表型的转化
通过免疫荧光、Western blot等实验,证实FABP4在3D培养的M1巨噬细胞中高表达,且FABP4抑制剂可抑制RA-FLSs和HUVECs的病理表型变化,揭示了FABP4通过PI3K/AKT信号通路影响细胞病理特征。
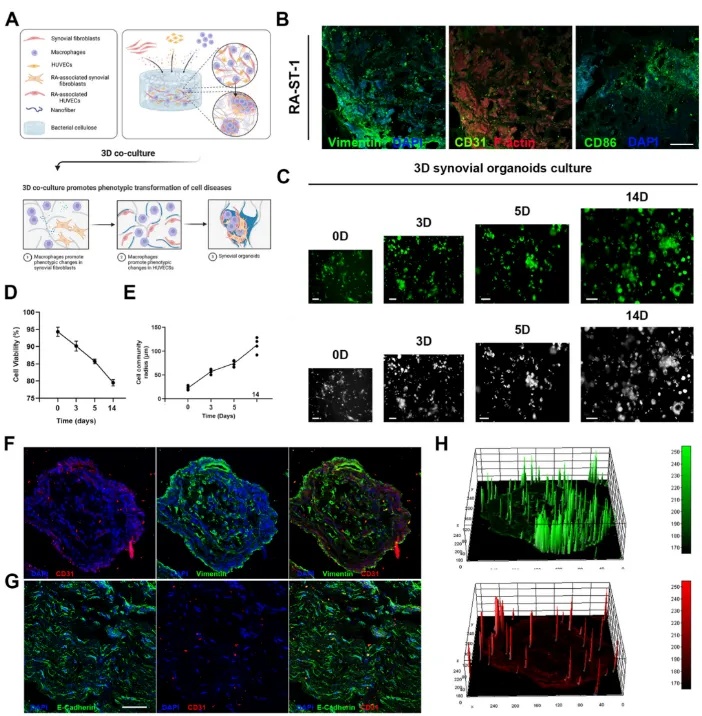
图6 3D滑膜类器官的表征
(A)通过在BC上共培养RA-FLS、HUVEC和巨噬细胞构建的滑膜类器官的示意图。(B)采用免疫荧光法检测RA患者滑膜组织中血管内皮细胞标志物(CD 31)、滑膜成纤维细胞标志物(Vimentin)和M1巨噬细胞标志物(CD 86)的表达。(C-E)在BC上连续培养14天期间,类器官的细胞活力和形态学分析。(F)类器官中特异性蛋白质的免疫染色,包括波形蛋白和CD 31。(G)类器官中特异性蛋白质的免疫染色,包括CD 31和E-钙粘蛋白。(H)Image J分析显示了波形蛋白和CD31在滑膜类器官中的空间表达。
五、类器官表征与药物筛选
对3D滑膜类器官进行免疫染色和分泌因子分析,发现其能很好地模拟RA滑膜组织的病理环境。利用该类器官对四种临床药物进行耐药性测试,结果表明3D滑膜类器官在药物筛选方面具有优势。
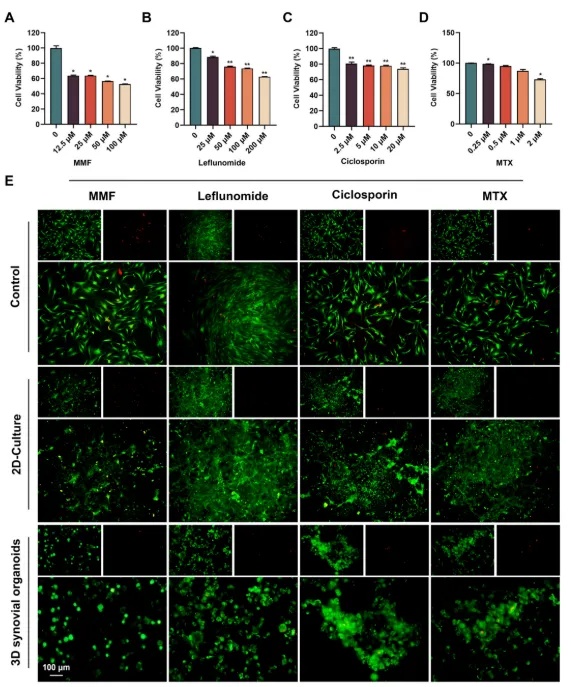
图7 3D滑膜类器官的药物试验
(A-D)用不同的类风湿临床药物,包括吗替麦考酚酯(MMF)、来氟米特、环孢素和甲氨蝶呤(MTX)治疗RA-FLS后的细胞活力。(E)类风湿性临床药物处理后,在不同培养条件下生长的RA-FLS的活/死染色(绿色=活细胞,红色=死细胞)。与对照组相比,*p < 0.05和 **p < 0.01。数据以平均值± SD表示。
作者构建了用于类风湿性关节炎研究的滑膜类器官,虽仍存在局限,但为后续模型构建提供了研究思路,未来研究可进一步完善模型,引入更多生理相关细胞,结合高通量技术深入分析细胞功能和相互作用,有望为RA治疗带来更多突破。