上海市浦东新区蔡伦路780号8层810室
新闻动态
文献分享 | 基于类器官模型的肿瘤研究:乳酸通过表观遗传调控肿瘤干性和可塑性
在结直肠癌(colorectal cancer, CRC)中,肿瘤组织仍部分保留其起源组织的层级结构,包括肿瘤干细胞(cancer stem cells, CSCs)和肿瘤分化细胞(cancer differentiated cells, CDCs)。CSCs广泛存在,并可能对结直肠癌的进展具有重要贡献。既往研究在体内模型和体外类器官中均观察到层级细胞谱系(CSCs 与 CDCs)以及细胞可塑性现象,尽管它们对治疗耐药性和癌症复发具有显著影响,但其具体调控机制及生物学优势尚未被完全阐明。
传统的二维细胞培养难以模拟肿瘤的三维结构、细胞间相互作用及微环境特征,导致筛选结果的可靠性受限。而患者来源的类器官(PDOs)或基因工程类器官能够高度保留原始肿瘤的遗传特征和异质性,在更接近生理状态的条件下进行药物筛选,其结果更具生理相关性与临床预测价值。
2025年2月10日,乌得勒支大学医学中心医学遗传学副教授Maria J. Rodríguez Colman团队在《Cell Metabolism》(IF=30.9)上发表题为“Lactate controls cancer stemness and plasticity through epigenetic regulation”的研究。该研究使用了人源结直肠癌类器官(TPO3和TPO4),这些类器官携带常见CRC突变(如APC、KRAS、p53、SMAD4),能够高度模拟体内肿瘤的遗传背景、组织结构及细胞异质性。结果显示乳酸通过表观遗传调控MYC表达,影响CSCs的维持与CDCs的去分化,进而增强肿瘤可塑性和恶性进展。类器官培养技术可更好地维持CSCs与CDCs的共存状态,结合荧光报告系统可实现干细胞活性与代谢状态的实时监测,为研究肿瘤层级结构和细胞可塑性提供了理想工具。以下为您带来该研究的详细解读:

原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00002-6
CSCs和CDCs表现出不同的乳酸代谢特征
以往研究显示小鼠肠道干细胞与分化细胞存在代谢差异并通过乳酸相互作用。研究人员首先探究了人类结肠瘤中是否存在类似现象。免疫荧光结果显示与隐窝底部 KRT20⁻ 细胞相比,顶部 KRT20⁺ 分化细胞 MCT4 表达更高,表明CDCs与CSCs相比具有更高的糖酵解能力。代谢特征分析表明,分化的肠上皮细胞糖酵解水平升高,而干细胞样细胞线粒体代谢评分更高。随后团队引入基于 Wnt 的干细胞报告基因 STAR 、代谢传感器 SoNar (NAD/NADH比例)和 laconic-NLS(检测乳酸水平)(图 1)。
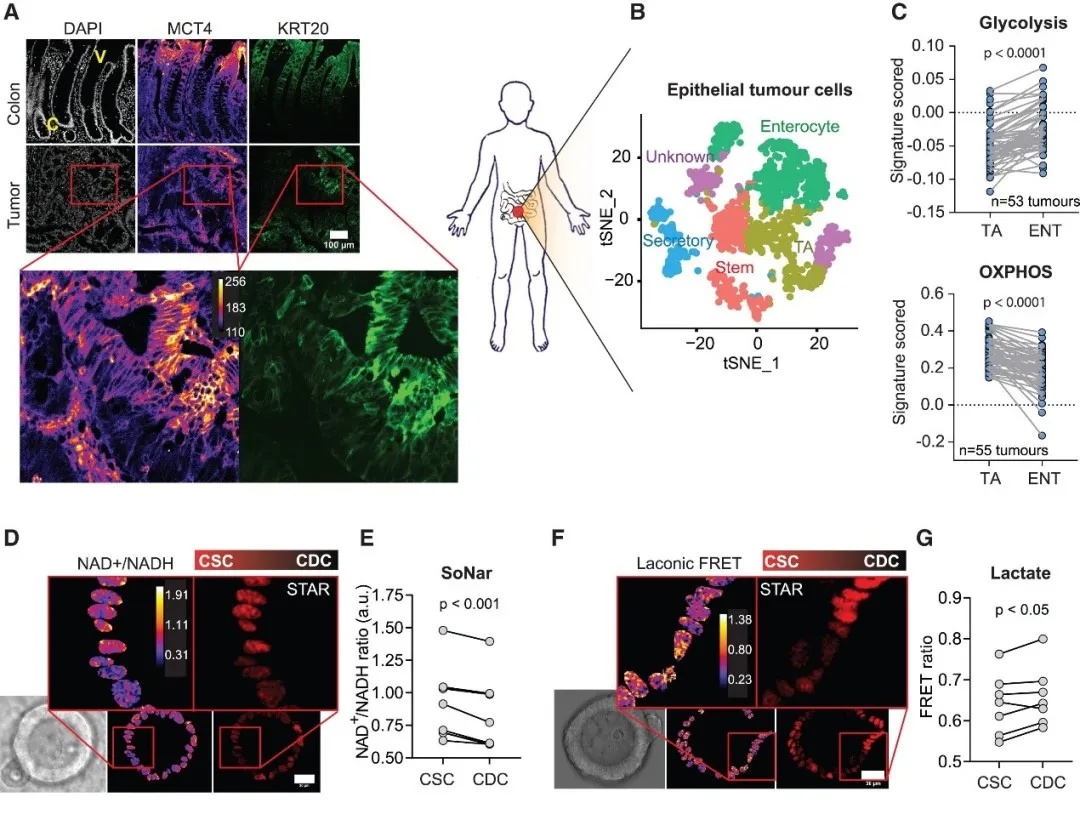
图1 CSCs和CDCs展现出不同的乳酸代谢特征
乳酸通过抑制分化和诱导去分化来增加CSCs数量
肿瘤微环境的显著特征是低葡萄糖和高乳酸水平。前期研究发现CDCs和CSCs通过乳酸相互作用。团队开发了 CellPhenTracker,一种利用机器学习驱动的4D单细胞追踪技术来观测细胞增殖、细胞命运。使用两株患者来源的肿瘤类器官TPO3、TPO4类器官研究乳酸在肿瘤发展中的作用。结果显示补充乳酸可以显著增加类器官中CSCs细胞群体。为研究乳酸诱导干性的机制,研究人员对STAR-TPO3类器官肿瘤发育进行了4D成像。将所有细胞分为分化、去分化和未改变三类。观察发现在对照条件下,类器官中的CSCs随时间减少,并且CSCs减少是由于细胞分化导致。36%的细胞转变为分化状态,去分化状态细胞比例较低。在乳酸条件下,细胞分化显著降低,去分化显著增加。以上结果说明乳酸诱导的CSCs通过分化抑制和显著诱导CDCs回归CSCs状态完成(图2)。
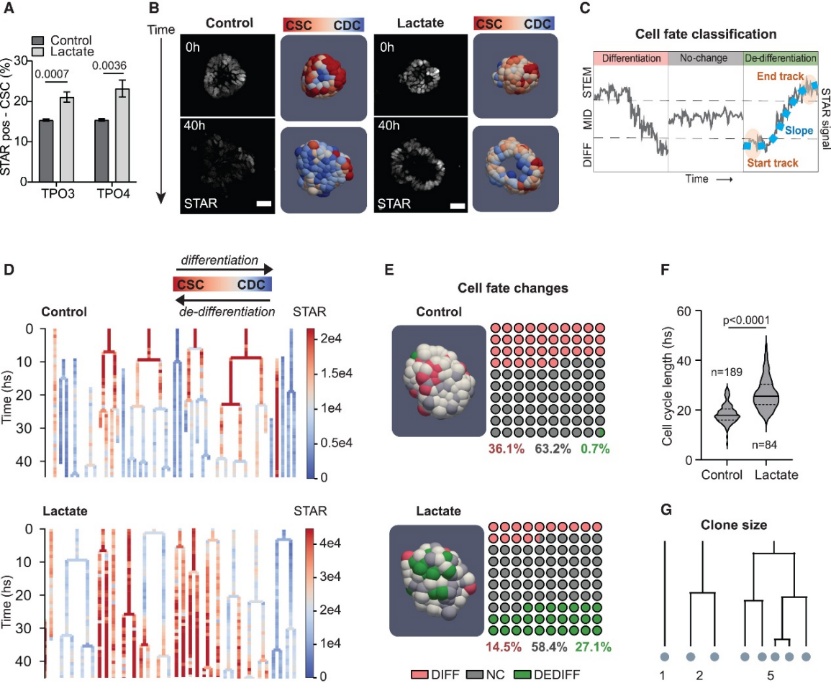
图2 乳酸通过抑制分化和诱导去分化
增加CSCs数量
乳酸增强MYC基因位点的组蛋白乙酰化和染色质可及性
研究人员进一步研究乳酸诱导代谢重编程是否通过生物能量学以外的机制调节干性。转录组分析显示,乳酸处理肿瘤类器官后134个基因表达显著变化,包括上调的MYC、JUN与组蛋白基因。Wnt信号、增殖、迁移及染色质重塑通路显著变化。乳酸处理增加组蛋白乙酰化水平,且免疫荧光显示CDCs(KRT⁺)的乙酰化水平低于CSCs(KRT⁻),表明CSCs乙酰化程度更高。随后CHIP-seq分析显示,乳酸上调MYC、JUN、组蛋白基因的启动子区域H3K27乙酰化修饰水平。同时乳酸处理可以增加MYC染色质可及性。Western Blot证实乳酸和DCA均增加MYC蛋白水平。使用多西环素诱导MYC过表达,可增加CSCs群体、抑制分化并激活去分化。以上结果显示乳酸对干性的调节依赖于MYC表达的表观遗传调控(图3)。
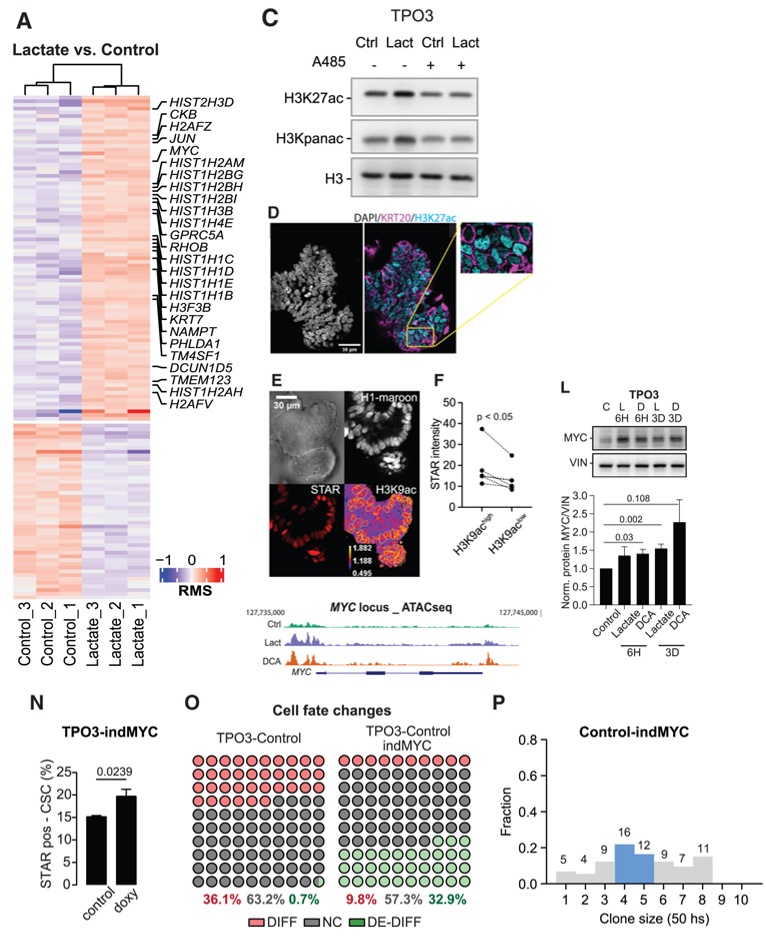
图3 乳酸增强 MYC 基因座处的组蛋白乙酰化和染色质可及性
本研究以类器官为核心模型,构建的TPO3和TPO4类器官来源于结直肠癌高频突变背景,能够自发形成类似体内肿瘤的层级结构,并同时维持CSCs与CDCs的状态,从而模拟临床肿瘤的细胞异质性及可塑性特征。该类器官对肿瘤微环境中的关键代谢物具有响应能力,展现出与体内肿瘤一致的代谢表型,为解析代谢物调控肿瘤动态过程提供了生理相关的体外模型。结合机器学习成像技术(CellPhenTracker),研究人员观察到CSCs与CDCs在乳酸代谢方面存在差异。研究进一步发现,乳酸通过抑制细胞分化并激活CDCs,促使其退行转化为增殖性CSCs,从而增加CSCs的数量,该过程由MYC的表观遗传调控介导。对肿瘤层级结构与代谢组织机制的深入理解,将有助于开发更有效的抗癌治疗策略。
