上海市浦东新区蔡伦路780号8层810室
新闻动态
文献分享 | 利用人类多能干细胞模拟人类骨骼发育
遗传性骨骼疾病一直以来都是重大的疾病负担,但针对这类骨骼疾病的分子机制探究较少且手段有限,导致缺乏有效的治疗方法。体外疾病模型系统有助于理解其分子病理学和寻找治疗方案,但目前不存在能真实地重现软骨成熟和骨形成所有步骤的模型系统。而人多能干细胞(hPSCs)的分化为研究人类发育提供了独特平台,但要模拟复杂组织和疾病的起源,必须了解支撑谱系特异性分化的发育回路。
针对这一问题,2022年6月5日,澳大利亚默多克儿童研究所团队在 《PNAS》 (IF=9.4)上发表了题为”Modeling human skeletal development using human pluripotent stem cells“的一篇文章,该研究描述了一种利用人诱导多能干细胞(iPSCs)体外重现软骨内骨化过程的方法,该方法可用于探索人类骨骼发育、模拟遗传骨骼疾病以及寻找新的治疗方法。

1、一种产生生长板或关节软骨类器官的可再生iPSC分化方法
在发育过程中,脊椎和肋骨软骨和骨从腹侧体节(硬节)产生。为了在体外概括这一过程,基于先前描述的6天iPSC分化方案诱导iPSC产生硬化体,监测特定阶段标记物的表达,发现多能性标记物 OCT4 逐渐下调,原基、轴旁中胚层 、体节中胚层和硬骨节标记物在适当发育阶段分别上调和下调。为促进硬骨节向软骨细胞分化,将第 4 天的细胞形成高密度小球,比较在硬骨节小球中添加 BMP4 或 FGF2 的效果,发现 FGF2 处理的小球软骨染色强且分化更均匀,后续实验均使用无饲养层 iPSC 并添加 FGF2。T3 对终末软骨细胞肥大和向成骨细胞转分化至关重要,用 T3 处理软骨球可促进均匀同步的肥大,转录分析显示 T3 刺激了基因表达变化,进一步检查 RNA-Seq 数据发现核心基质体 基因的表达变化,体外软骨细胞分化过程中许多转录因子的表达与骨骼发育和成熟过程中的调节相似,还发现了在软骨发育中作用不太明确但在肥大过程中上调或下调的转录因子。iPSC 软骨细胞分化方案可可靠地产生直径约 2.5 至 3 毫米的类器官,比较两个 iPSC 系的三次独立分化的转录组,表明软骨生成分化和成熟的轨迹是可重复的,但在后期发育阶段和肥大阶段可能存在小的转录组差异(图1)。
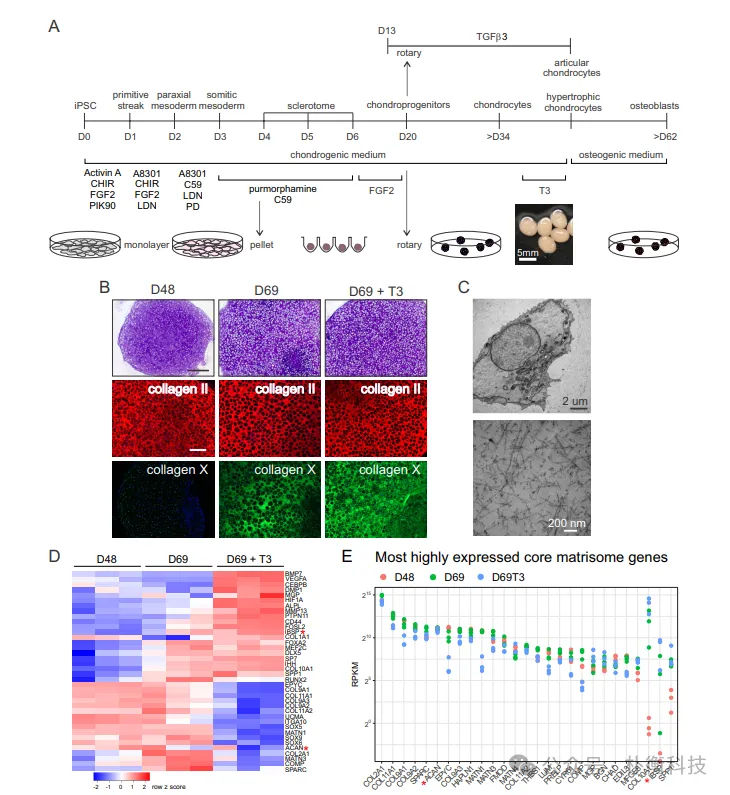
图1
2、PSC衍生的肥大软骨细胞可以在体内和体外转化为成骨细胞和骨细胞
将 iPSC 来源的肥大软骨球(D42)移植到免疫缺陷小鼠皮下,13 周后分析发现移植物中有残留软骨及可识别的骨组织,且植入物中的软骨和骨均来自人类细胞,表明体外分化的肥大软骨细胞在体内信号提示下可转变为成骨细胞。此外在成骨培养基中培养 3 周后,转录分析显示软骨胶原蛋白 II 和聚集蛋白聚糖下调,而成骨细胞标志基因上调,骨中的主要胶原蛋白 I 和成熟成骨细胞蛋白骨钙素沉积到细胞外基质中,细胞还表达成熟骨细胞蛋白硬骨素,微计算机断层扫描分析证实类器官中有广泛矿物沉积,表明向骨样状态转变。许多在成骨条件下高度表达和上调的核心基质体基因在体外实验中与体内成骨细胞和骨细胞表达的一组编码细胞外基质蛋白的基因相似,且基因表达变化模式在另一 iPSC 系来源的软骨球实验也得到再现。这些基因表达数据表明体外软骨细胞向成骨细胞的转变方案重现了体内成骨细胞发育的关键过程,为进一步了解肥大软骨细胞向成骨细胞转变的调控机制提供了机会(图2,3)。
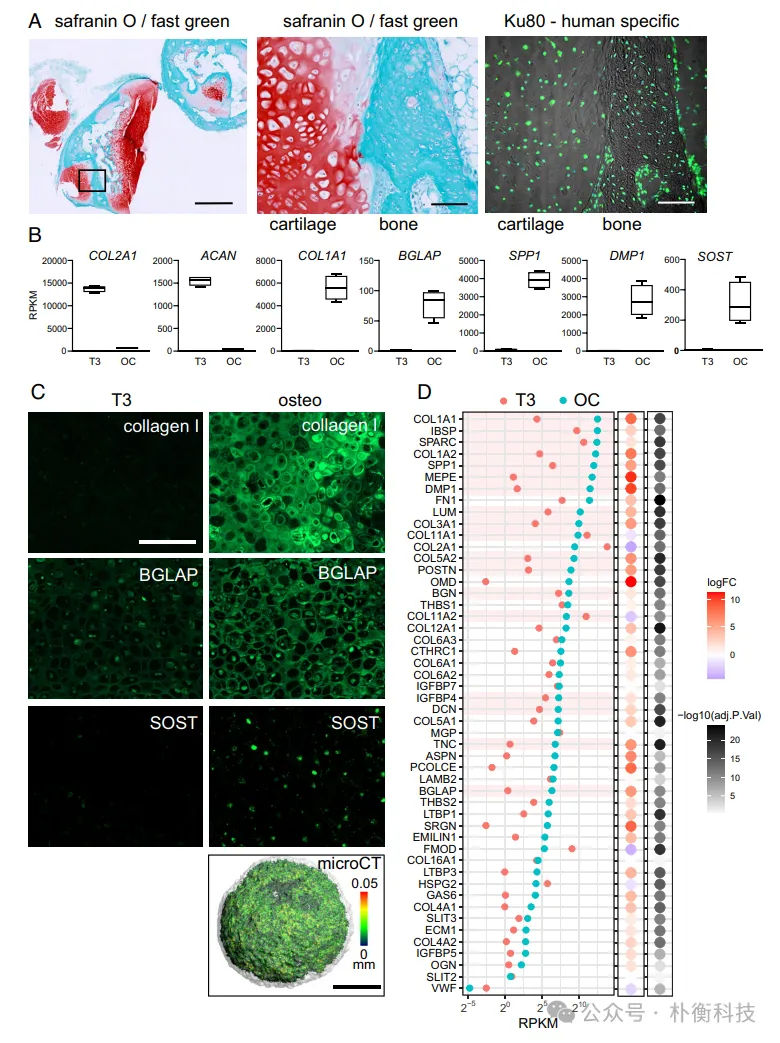
图2
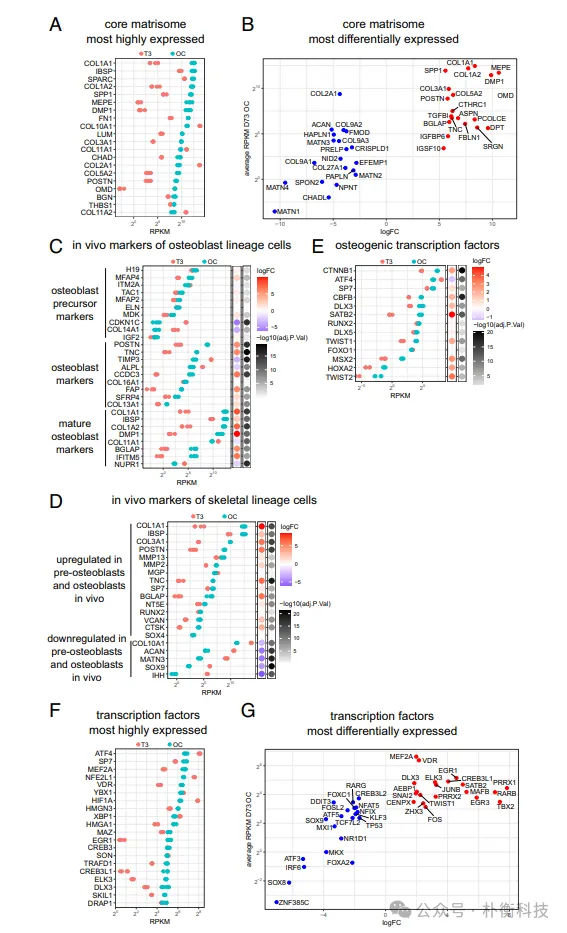
图3
3、模拟人类骨骼疾病
随后研究者分析了利用诱导多能干细胞(iPSC)分化方案模拟人类遗传骨骼疾病的可行性。对于携带导致软骨发育不全的杂合 COL2A1 p.G1113C 突变的 iPSC 分化出的软骨,其细胞外基质中胶原蛋白 II 较少,软骨细胞内有强烈的胶原蛋白 II 染色,反映出胶原蛋白错误折叠和滞留,细胞外基质中的胶原纤维紊乱稀疏,与人类患者软骨和携带 COL2A1 突变的小鼠中的胶原蛋白 II 纤维相似。对于携带围产期致死性成骨不全突变 COL1A1 p.W1312C 的 iPSC,分化为软骨细胞再到成骨细胞后,细胞外基质中的胶原蛋白 I 染色不如同基因对照组强烈,与该患者的成纤维细胞沉积的胶原蛋白 I 减少情况一致。该患者的长骨显示出成骨成熟缺陷。携带该突变的 iPSC 来源的成骨类器官矿物质无法沉积,可通过微计算机断层扫描检测到,这与体内成骨成熟缺陷一致。这种在体外重现 COL1A1 和 COL2A1 骨骼疾病表型关键特征的能力有望促进对疾病机制的详细研究、确定治疗靶点以及为患者筛选新的药物治疗方法(图4)。
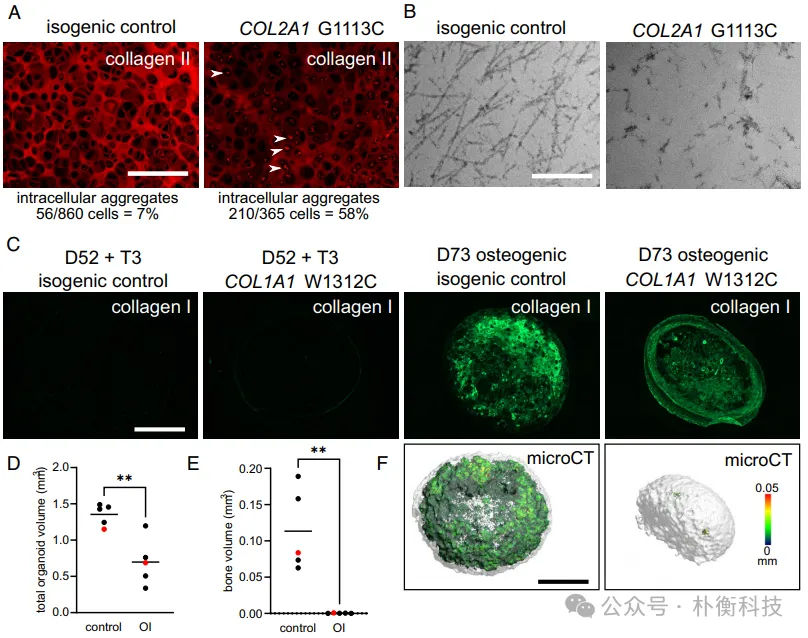
图4
