上海市浦东新区蔡伦路780号8层810室
服务案例
成果解读 | 朴衡人源化3D肝模型精准验证肠源代谢物IPA逆转肝纤维化
近年来研究发现,肠道代谢物经门静脉系统进入肝脏后,可参与调控肝脏炎症反应与纤维化进程。这一机制为开发靶向“微生物-代谢物-免疫”交互作用的抗纤维化治疗策略提供了新的研究方向。以往基于肝纤维化的研究多依赖原代肝星状细胞和小鼠模型。其中原代肝星状细胞培养中表型不稳定,易去分化,并且难以模拟体内真实的复杂肝脏微环境。物种差异导致小鼠与人在肝脏免疫系统等方面存在显著不同,导致对纤维化可逆性的模拟并不理想。因此选用合适的人源化模型去研究肠代谢物在肝纤维化中的具体作用及机制具有重要意义。
朴衡博迈推出的人源化3D肝纤维化模型(NF-HS-2-01)克服了传统肝类器官细胞成熟度不足以及细胞类型单一的缺陷,使用功能成熟的人源肝实质与肝非实质细胞进行建模。该模型的药物代谢酶谱及基因表达谱都更贴近人类肝纤维化病变特征,是研究肝纤维化发病机制和进行高通量药物筛选的理想工具。
近日,同济大学曾欣团队联合长征医院林勇团队发表在《Cellular & Molecular Immunology 》(IF= 19.8)杂志的最新研究成果,使用我司人源化3D肝纤维化模型(NF-HS-2-01)解析了吲哚丙酸(IPA)在抗纤维化中的潜在机制。研究表明IPA靶向AhR/NF-κB/S100A8/A9轴和AhR/SPHK2/S1P信号传导,抑制巨噬细胞的促纤维化生物学特性,并在人源化3D肝纤维化模型上验证巨噬细胞与肝星状细胞(HSC)之间的促纤维化串扰。该研究加深了肠道代谢物通过肠-肝轴对肝纤维化影响的理解,支持了IPA的转化潜力。通过靶向促纤维化的巨噬细胞,IPA有望成为肝纤维化临床治疗的一种有希望的候选药物。

Cellular & Molecular Immunology
8 September, 2025
DOI: 10.1038/s41423-025-01339-x
原文链接:https://www.nature.com/articles/s41423-025-01339-x
结果一:肠道来源的IPA在体内发挥抗纤维化作用
研究者通过代谢组学与宏基因组学发现在肝硬化患者和纤维化小鼠模型中,肠道菌群来源的IPA在粪便和血清中的水平显著降低。口服补充IPA可通过肠道-肝脏轴被转运至肝脏,并显著减轻多种模型诱导的肝纤维化。以上结果显示了IPA抗纤维化的潜力。随后研究者利用荧光标记示踪技术,对IPA进行体内示踪,结果显示IPA在肝脏中被F4/80⁺巨噬细胞特异性摄取,而非肝细胞或肝星状细胞(图1)。
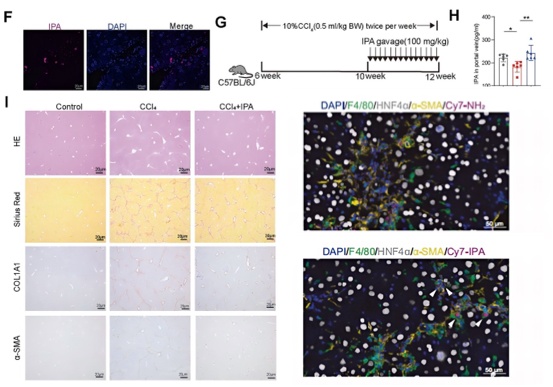
图1 肠道来源IPA具有抗纤维化作用且作用于巨噬细胞
结果二:人源化3D NAC-Organ验证IPA通过巨噬细胞-HSC轴改善肝纤维化
为进一步模拟和探究IPA在人体中的治疗效果,研究团队采用了朴衡博迈特有的人源化3D NAC-Organ 肝纤维化模型进行实验。通过组织学(H&E染色、天狼猩红染色)和免疫组化分析发现,IPA处理显著减轻了类器官中胶原纤维的沉积,并降低了促纤维化关键蛋白(如COL1A1和α-SMA)的表达水平。同时,通过ELISA检测模型培养上清液证实,IPA处理还显著下调了多种促炎细胞因子(如TNF-α, IL-1β)的分泌。综上,IPA在高度模拟人体肝脏复杂结构的功能性3D模型中,能够有效抑制纤维化进程和炎症反应,这不仅重复了在动物模型中观察到的表型,更关键的是它证实了IPA对人体来源的肝细胞和非实质细胞(尤其是巨噬细胞和HSC)同样具有高效的抗纤维化作用,极大地增强了研究发现向临床转化应用的说服力和潜在价值。
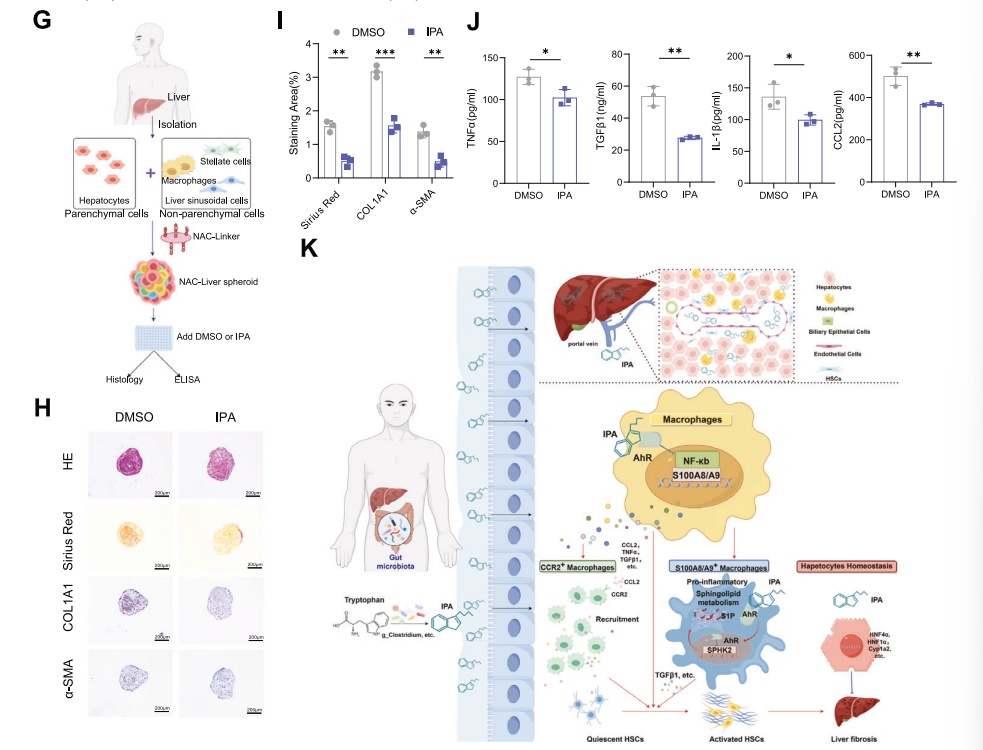
图2 3D 肝纤维化模型验证IPA的抗纤维化作用
本研究分析并证实了IPA的抗纤维化作用。作者提出IPA影响促纤维化巨噬细胞表型和生物学功能的潜在机制,并在人源化3D肝纤维化模型上得到验证,从而更深入地探究了肠道来源代谢物通过肠-肝轴在肝纤维化中的作用。这些发现具有转化价值,并为开发针对肠源性代谢物的抗纤维化策略开辟了新的方向。
